
¿Qué es el Paladio?
Paladio es un elemento químico o metal maleable de alta densidad, brillante, blanco plateado del grupo 10 de la tabla periódica con número atómico 46 y símbolo Pd. Los elementos a saber, rutenio, rodio, paladio, osmio, iridio y platino se denominan metales de platino.
Químicamente, el metal paladio es inerte al ataque de ácidos minerales y aire o agua en condiciones normales. Casi todos los compuestos se descomponen para producir Pd cuando se calientan. Todos estos elementos son raros en la corteza terrestre. El elemento paladio se encuentra junto a otros metales preciosos como el cobre, la plata y el oro.
descubrimiento de paladio
El paladio es el segundo metal de platino descubierto en 1803 por el químico inglés W Wollaston. Fue aislado e identificado durante la investigación del platino crudo. Llamó al metal después de que el asteroide Palas fuera descubierto un año antes. Le puso el nombre de la diosa griega de la sabiduría.
Propiedades del paladio
Químicamente, todos los metales del platino (Ru, Rh, Pd, Os, Ir, Pt) son relativamente nobles. Son relativamente inertes al ataque de ácidos minerales y agua en condiciones normales. El Os y el Pd se disuelven lentamente en ácidos oxidantes como el ácido sulfúrico o el nítrico.
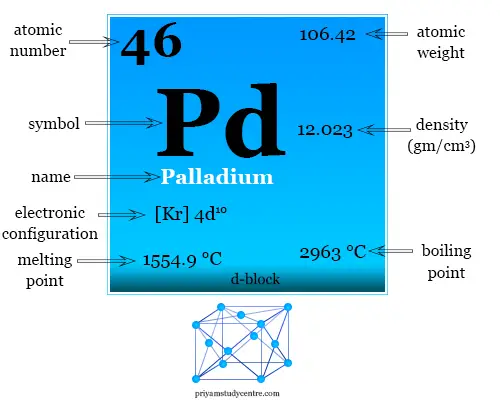
Tiene las notables propiedades de absorber hidrógeno molecular en grandes volúmenes. La configuración electrónica y algunas propiedades físicas y químicas del paladio se dan debajo de la tabla,
| Propiedades del paladio |
||
| número atómico | 46 | |
| Configuración electrónica | [Kr] 4d10 | |
| Peso atomico | 106.42 | |
| Punto de fusion | 1554,9 ºC | |
| Punto de ebullición | 2963 ºC | |
| Espesor | 12,023 g/cm3 | |
| Capacidad calorífica molar | 25,98 J mol−1 k−1 | |
| Resistencia eléctrica | 105,4 nΩ·m | |
| estructura cristalina | cúbico centrado en las caras (fcc) | |
| Grupo | grupo-10 | |
| Período de tiempo | periodo-5 | |
| Bloquear | bloque d | |
| Propiedades químicas | ||
| número de oxidación | +2, +4 | |
| electronegatividad | Escala de Pauling: 2,20 | |
| Energía de ionización (kJ/mol) |
1º | 2do |
| 804.4 | 1870 | |
De los elementos del grupo 10 como Ni, Pd y Pd, la energía de ionización aumenta al aumentar el número atómico. Debido a la construcción de los lantánidos, el radio atómico de Pd y Pt es el mismo.
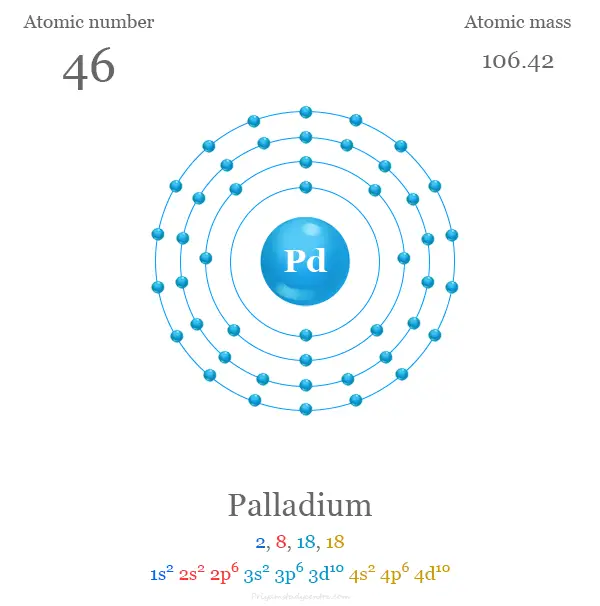
Configuración electrónica del paladio
Los 46 electrones del átomo de Pd se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica que se muestra debajo de la imagen,
Paladio en la tabla periódica
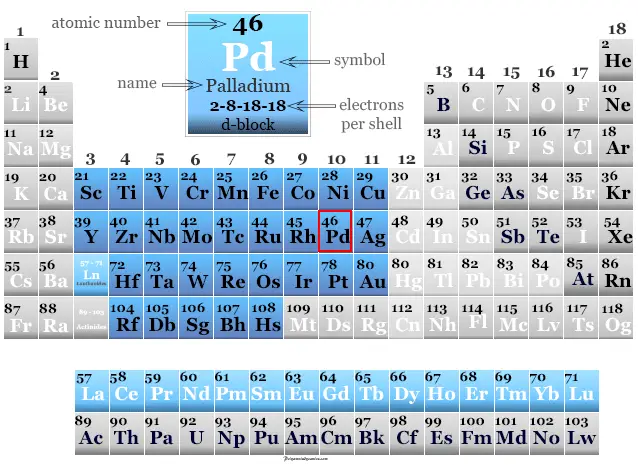
El paladio se coloca en el grupo 10 y el período 5 de la tabla periódica con elementos del bloque d o metales de transición. La configuración electrónica de la capa de valencia de platino es: [Kr] 4d10. Tiene muchas similitudes con el platino de un miembro del grupo. El número o estado de oxidación +2 y +4 es el más común para ambos metales.
¿Dónde se encuentra el paladio?
Las principales fuentes de paladio son Sudáfrica, Canadá, Rusia, Brasil, Colombia, etc. Es raro en la corteza terrestre y se encuentra alrededor de 0,015 ppm. Los minerales de sulfuro de cobre o níquel del distrito de Sudbury del estado de Ontario (Canadá) deben contener la mayor cantidad de Pd. Grandes cantidades de paladio se recuperan como subproducto del sulfuro de cobre o níquel.
isótopos
El paladio natural contiene siete isótopos. El isótopo radiactivo 107Pd es el más estable (vida media 6,5 millones de años). Otros dieciocho isótopos radiactivos se obtienen mediante diferentes tipos de reacciones nucleares. Estos isótopos tienen una vida media muy corta.
Proceso de producción
Los metales de platino generalmente se extraen del mineral de cobre o níquel. En la producción de cobre o níquel, el lodo del ánodo contiene alrededor del 4 por ciento de metales de platino.
La separación y el aislamiento de los metales de platino individuales se basan en sus propiedades frente a los ácidos o en las diferencias de solubilidad de sus complejos.
- En el tratamiento del lodo anódico con agua regia, el Pd junto con el Au y otros metales de platino son solubles para formar complejos de cloro. Paladio del complejo como H2PdCl4.
- De la solución, el oro es precipitado por FeSO4.
- La solución con H2PdCl4 el resto después de la precipitación del platino se trata con amoníaco acuoso en exceso seguido de HCl. la precipitación de [Pd(NH3)2]kl2 se purifica por precipitación y se calcina para obtener paladio.
- El elemento paladio se obtiene en forma de esponja en polvo. Está compactado mediante técnica metalúrgica.
uso de paladio
- El paladio tiene notables propiedades para absorber gas hidrógeno que permanece en estado activo. Debido a su capacidad para absorber hidrógeno, se utiliza como catalizador químico en varios tipos de reacciones industriales y de laboratorio.
- Se utiliza en varias reacciones catalíticas importantes, como la hidrogenación de acetileno a etileno.
- Se utiliza para la producción de peróxido de hidrógeno por oxidación reducción de 2-etilantraquinol y 2-etilantraquinona.
- Para fabricar condensadores cerámicos multicapa, utilizamos una gran cantidad de aleación de Pd-Ag.
- También se utiliza como otro tipo de material para fabricar componentes electrónicos o materiales de soldadura.
- Las membranas de paladio se utilizan para la producción de gas hidrógeno puro debido a las propiedades de absorción del paladio.
- Los electrodos de hidrógeno de paladio se utilizan ampliamente en varias celdas electroquímicas.
- No se ennegrece con sulfuro de hidrógeno (H2S). Por lo tanto, se utiliza para la fabricación de joyas.
Ingredientes químicos
Los estados de oxidación +4 y +2 son los estados de oxidación más comunes para el elemento paladio. El estado de oxidación más alto del elemento Pd es +4. PDF4 es el único tetrahaluro en el estado +4. fluoración de K2[PdCl4] da k2PDF6. El anión PdF6−2 es termodinámicamente inestable a la hidrólisis.
Forma numerosos complejos que son planificadores diamagnéticos y en su mayoría cuadrados. A continuación se analizan algunos compuestos químicos comunes del paladio en diferentes estados de oxidación.
Óxido de paladio
Se prepara un óxido de color negro (PdO) calentando paladio en oxígeno. PdO se disocia por encima de 875 °C y es insoluble en todos los ácidos.
Un precipitado gelatinoso de color amarillo oscuro del óxido hidratado PdO, xH2El O se puede obtener agregando álcali en Pd acuoso (NO3)2. Es soluble en ácidos, pero no se puede secar completamente.
Cloruro de paladio
El cloruro de Pd(II) tiene dos formas, α-PdCl2 y -PdCl2. Calentar metal Pd en cloro por encima de 550 °C produce α-PdCl2 que cambia lentamente a β-PdCl2.
- La forma α tiene una estructura de cadena planificadora infinita.
- Pero el β-PdCl2 forma una estructura octaédrica. Toda la unidad tiene la fórmula molecular Pd6kl12 pero no hay indicios de unión de Pd-Pd. El cloruro de paladio es soluble en agua y acepta iones de cloruro en PdCl. Dar forma42.











Deja una respuesta