
¿Qué es el iterbio?
Iterbio es un elemento químico o metal de tierras raras en la tabla periódica con el símbolo yb y número atómico 70. El metal puro es un elemento químico suave, maleable y maleable que exhibe un brillo plateado brillante. La densidad, el punto de fusión y el punto de ebullición del iterbio difieren de otros metales de tierras raras debido a su configuración electrónica de capa cerrada.

Es un componente útil para hacer el reloj atómico más estable del mundo. Se ha avanzado mucho en la tecnología de fibra óptica tras el uso de láseres ópticos dopados con iterbio.
El iterbio fue descubierto en 1879 por el químico suizo Jean Charles Galissard de Marignac mientras examinaba muestras de gadolinita. Encontró un nuevo componente de gadolinita conocido como erbia. Lo llamó iterbia por Ytterby, que significa el pueblo sueco cerca de donde se encontró el nuevo componente de erbio.
¿Dónde se encuentra el iterbio?
El iterbio es el 44º elemento más abundante en la corteza terrestre y una de las tierras raras más abundantes que se encuentran con otros minerales de tierras raras.
El mineral más común y comercialmente importante del metal es la monacita. El elemento también se encuentra en los minerales euxenita y xenotima.
La principal zona minera de iterbio metálico es China, Estados Unidos, Brasil, India, Sri Lanka y Australia. Se puede extraer y separar de otros minerales de tierras raras mediante cromatografía de intercambio iónico y extracción con solvente.
isótopos
El iterbio natural es una mezcla de siete isótopos estables con masas atómicas que van desde 168 a 176. El isótopo más abundante es el iterbio-174, que se encuentra en aproximadamente el 31,8 por ciento de la abundancia natural. Se han obtenido al menos 27 isótopos radiactivos a través de diversas reacciones nucleares.
La mayoría de estos isótopos radiactivos tienen una vida media de menos de 20 minutos. El principal modo de desintegración radiactiva de los isótopos de iterbio es la captura de electrones o desintegración beta. También muestra 12 isótopos metaestables, el más estable de los cuales es el iterbio-169m.
Propiedades
El iterbio plateado y blando se oxida lentamente en el aire formando una capa superficial protectora. El polvo de iterbio finamente dividido se encenderá en el aire.
| Iterbio | |||
| Símbolo | yb | ||
| Descubrimiento | Jean Charles Galissard de Marignac en 1878 | ||
| Nombre derivado de | Del mineral Ytterby encontrado en Suecia | ||
| isótopos comunes | 70yb172, 70yb173y 70yb174 | ||
| Estados de oxidación | +3, +2 | ||
| número CAS | 7440-64-4 | ||
| Propiedades periódicas | |||
| número atómico | 70 | ||
| Masa atómica relativa | 173,045 | ||
| electrón por celda | 2, 8, 18, 32, 8, 2 | ||
| Configuración electrónica | [Xe] 4f14 6s2 | ||
| Bloquear | bloque f | ||
| Grupo | lantánidos | ||
| Período de tiempo | 6 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 824°C, 1097K | ||
| Punto de ebullición | 1196 °C, 1469 K | ||
| Capacidad calorífica molar | 26,74 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en las caras (fcc) | ||
| Espesor | 6,90 g/cm23 | ||
| Calor de fusión | 7,66 kJ mol−1 | ||
| Calor de evaporación | 129 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.26 | ||
| Radio covalente | 1.78 | ||
| Electronegatividad | Desconocido | ||
| Afinidad electronica | −1,93 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 603.43 | 1174.80 | 2416.96 | |
Iterbio en la tabla periódica
El iterbio, un metal de tierras raras, se coloca en la tabla periódica con elementos de bloque f. Es un lantánido que se encuentra entre el tulio y el lutecio.
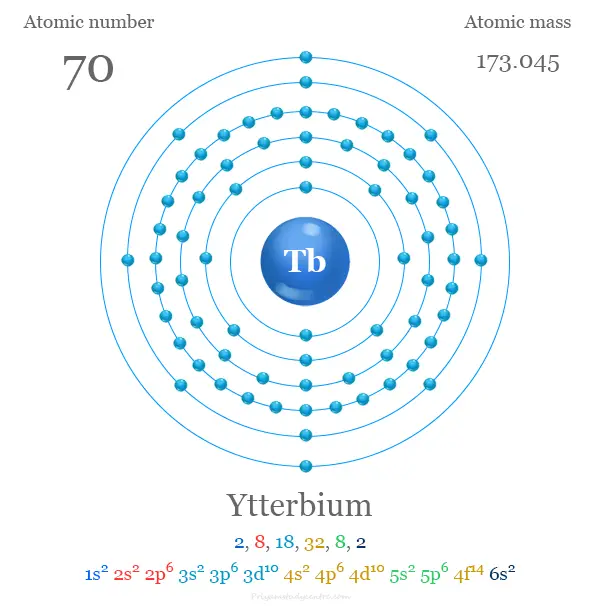
Configuración electrónica del iterbio
Los 70 electrones del átomo de iterbio se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica,
Propiedades químicas
Al igual que otros lantánidos, el número de oxidación o estado de oxidación más común del iterbio es +3, pero el estado de oxidación +2 también es estable debido a la f14 configuración de la Yb+2 ion. Reacciona con hidrógeno para formar varios compuestos de hidruro no estequiométricos.
El iterbio es un metal de tierras raras altamente reactivo y electropositivo que es estable en aire seco a temperaturas normales, pero se empaña rápidamente en atmósferas húmedas. Reacciona fácilmente con oxígeno para formar óxido de Yb(III) Yb. Dar forma2O3.
4 Yb + 3 O2 → 2 Yb2O3
El iterbio está muy por encima del hidrógeno en la serie electroquímica. Por lo tanto, reacciona lentamente con agua fría y rápidamente con agua caliente para liberar hidrógeno y formar hidróxido de Yb(III).
2 Yb + 6 H2O → 2 Yb(OH)3 + 3 horas2
Forma tanto dihaluros como trihaluros cuando reacciona con halógenos como flúor, cloro, bromo y yodo.
2 Yb + 3 X2 → 2 YbX3 (X = F, Cl, Br, I)
Los dihaluros se oxidan a trihaluros a temperatura ambiente, pero son desproporcionados con los trihaluros y el iterbio metálico a altas temperaturas.
3 YbX2 → 2 YbX3 + Yb (X = F, Cl, Br, I)
Se disuelve fácilmente con ácidos minerales fuertes como el ácido sulfúrico, el ácido nítrico o el ácido clorhídrico. En ácido sulfúrico diluido forma una solución que contiene el Yb incoloro. contiene+3 iones que existen como complejos de nonahidratos. Se disuelve en amoníaco para formar sales de electrodos azules.
2 Yb + 3 H2ASI QUE4 + 18 horas2O → 2 [Yb(H2O)9]3+ + 3 SO4−2 + 3 horas2
Datos sobre el iterbio
- El iterbio es un metal plateado brillante y brillante que es más reactivo que los otros elementos lantánidos. Por lo tanto, generalmente se almacena en recipientes sellados para protegerlo del oxígeno y las atmósferas húmedas.
- La configuración electrónica de valencia del átomo de Yb en el estado +2 es [Xe] 4f14 con un f-shell completamente lleno. Por lo tanto, el estado +2 del metal es relativamente estable debido a la configuración de capa f completamente llena.
- Solución acuosa incolora que contiene solo Yb+3 porque el amarillo verdoso Yb+2 El ion es un agente reductor muy fuerte que descompone el agua.
- El metal de iterbio puro se puede producir después del descubrimiento de la cromatografía de intercambio iónico.
- Se encuentra principalmente en el mineral monacita y se extrae o separa mediante cromatografía de intercambio iónico y extracción con disolvente.
- El precio de los metales es relativamente más estable que el de otros elementos de tierras raras.
- El iterbio de baja toxicidad no juega ningún papel biológico en humanos y otros animales.
- El iterbio metálico en forma de polvo provoca fuego en contacto con el aire.
- Se utiliza para reemplazar catalizadores industriales demasiado tóxicos y contaminantes.
Uso de iterbio
- Se utiliza para fabricar el reloj atómico más estable del mundo. Una gran cantidad de átomos es el factor clave para la alta estabilidad de los relojes atómicos.
- El ion Yb(III) es un dopante utilizado en láseres de estado sólido y láseres de fibra de doble revestimiento.
- Se han logrado grandes avances en la tecnología de fibra óptica tras el descubrimiento de las fibras ópticas dopadas con iterbio.
- El iterbio es un agente dopante para mejorar el refinamiento del grano y la resistencia mecánica del acero inoxidable.
- Al igual que otros metales de tierras raras, se puede utilizar para fabricar condensadores cerámicos y otros dispositivos electrónicos,
- Se utiliza como catalizador químico industrial para controlar varios procesos industriales. Se ha utilizado para sustituir a otros catalizadores industriales demasiado tóxicos y contaminantes.
- Actualmente, el iterbio metálico se utiliza para fabricar dispositivos de memoria y láseres sintonizables.
















Deja una respuesta