Que diferencia principal entre la reacción de NaBH4 y LiAlH4 es que NaBH4 es un agente reductor débil mientras que LiAlH4 es un agente reductor fuerte.
Tanto NaBH4 como LiAlH4 son agentes reductores. Estas son las fuentes más comunes de nucleófilos de hidruro que usamos en las reacciones de síntesis orgánica. El nombre de NaBH4 es borohidruro de sodio, mientras que el nombre de LiAlH4 es hidruro de litio y aluminio.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la reacción de NaBH4?
3. ¿Qué es la reacción de LiAlH4?
4. Comparación lado a lado: respuesta de NaBH4 frente a LiAlH4 en forma tabular
5. Resumen
¿Qué es la reacción de NaBH4?
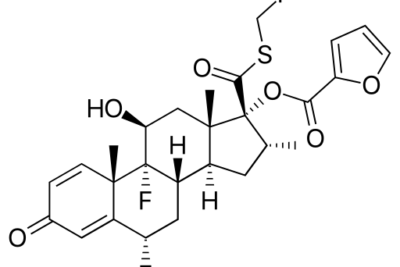
La reacción NaBH4 es un tipo de reacción redox donde NaBH4 es el agente reductor. La fórmula química NaBH4 significa borohidruro de sodio. Es una de las fuentes más comunes de nucleófilos de hidruro. Este compuesto tiene un enlace metal-hidrógeno polar. Por lo tanto, durante la reacción redox, no podemos encontrar el anión hidruro; por lo tanto, este reactivo sirve como fuente de hidruro debido a la presencia de este enlace metal-hidrógeno. Sin embargo, si comparamos NaBH4 con LiAlH4, el enlace metal-hidrógeno de LiAlH4 es más polar; por lo tanto, es un agente reductor más fuerte que NaBH4. Esto se debe principalmente a que el aluminio es más electronegativo en LiAlH4 que el boro en NaBH4.
El borohidruro de sodio puede reducir muchos compuestos carbonílicos orgánicos. Por lo general, esta sustancia se usa en el laboratorio para convertir una cetona o un aldehído en un alcohol. Además, las reacciones de NaBH4 pueden reducir de manera eficiente los cloruros de acilo, los anhídridos, los tioésteres y las iminas a temperatura ambiente. Además, NaBH4 reacciona con agua y alcoholes para formar hidrógeno gaseoso y una sal de borato.

Figura 01: Estructura química de NaBH4
Además, las reacciones de NaBH4 usan un alcohol (como metanol o etanol) como solvente para reducir cetonas o aldehídos. Sin embargo, la reactividad de NaBH4 puede mejorarse o mejorarse con varios compuestos, como el metanol.
¿Qué es la reacción de LiAlH4?
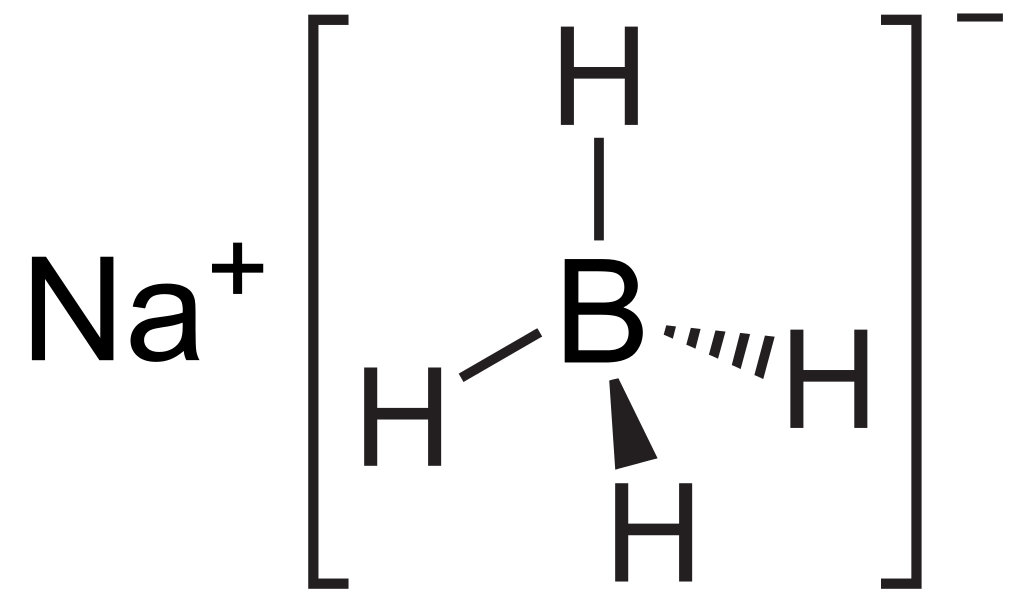
LiAlH4 es un tipo de reacción redox donde LiALH4 es el agente reductor. La fórmula química LiAlH4 significa hidruro de litio y aluminio. Tiene cuatro enlaces metal-hidrógeno que son altamente polares debido a la diferencia de electronegatividad entre los átomos de litio e hidrógeno. Esto hace que el compuesto sea un poderoso agente reductor. Además, este compuesto existe como un sólido a temperatura ambiente, donde es extremadamente reactivo con el agua y emite gas hidrógeno al reaccionar con el agua. Esta reacción es muy peligrosa debido a la alta reactividad de la mezcla de reacción.

Figura 02: Estructura química de LiAlH4
LiAlH4 puede convertir ésteres, ácidos carboxílicos, cloruros de acilo, aldehídos y cetonas en el alcohol correspondiente. Además, puede convertir amidas, compuestos de nitrilo, azidas y nitrocompuestos en las aminas correspondientes.
¿Cuál es la diferencia entre la reacción de NaBH4 y LiAlH4?
NaBH4 y LiAlH4 son los agentes reductores más comunes en química orgánica. La principal diferencia entre NaBH4 y LiAlH4 es que NaBH4 es un agente reductor débil, mientras que LiAlH4 es un agente reductor fuerte. Comparando NaBH4 con LiAlH4, el enlace metal-hidrógeno de LiAlH4 es más polar; por lo tanto, es un agente reductor más fuerte que NaBH4. Esto se debe principalmente a que el aluminio es más electronegativo en LiAlH4 que el boro en NaBH4.
Resumen - Respuesta NaBH4 frente a LiAlH4
Un agente reductor es una sustancia química que puede reducir otra sustancia mientras se oxida. NaBH4 y LiAlH4 son los agentes reductores más comunes en química orgánica. La principal diferencia entre NaBH4 y LiAlH4 es que NaBH4 es un agente reductor débil, mientras que LiAlH4 es un agente reductor fuerte.
Relación:
1. Welker, Martín. "Química Orgánica II". 3. Reducciones usando NaBH4, LiAlH4 | Química orgánica II. Np y Web. 26 de junio de 2020.
Imagen de cortesía:
1. "Borohidruro de sodio" por Kemikungen - Trabajo propio (Dominio público) a través de Commons Wikimedia
2. "Hidruro de litio y aluminio" por Kemikungen - Trabajo propio (Dominio público) a través de Commons Wikimedia





Deja una respuesta