Que diferencia principal entre Arrhenius y Eyring es la ecuación La ecuación de Arrhenius es una ecuación empírica mientras que la ecuación de Eyring se basa en el razonamiento estadístico-mecánico.
La ecuación de Arrhenius y la ecuación de Eyring son dos ecuaciones importantes en química física. Si asumimos una entalpía de activación constante y una entropía de activación constante, la ecuación de Eyring es similar a la ecuación empírica de Arrhenius.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la ecuación de Arrhenius?
3. ¿Qué es la ecuación de Eyring?
4. Comparación lado a lado: ecuación de Arrhenius frente a ecuación de Eyring en forma tabular
5. Resumen
¿Qué es la ecuación de Arrhenius?
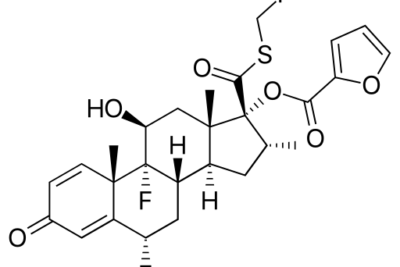
La ecuación de Arrhenius es una fórmula química que incluye la dependencia de la temperatura de las velocidades de reacción. Esta ecuación fue propuesta y desarrollada por el científico Svante Arrhenius en 1889. La ecuación de Arrhenius tiene muchos usos para determinar la velocidad de las reacciones químicas y calcular la energía de activación. En este contexto, la ecuación de Arrhenius proporciona una justificación física y una interpretación de la fórmula. Por lo tanto, podemos identificarla como una relación empírica. La ecuación de Arrhenius se expresa de la siguiente manera:
K = Ä(EA/RT)
donde k es la constante de velocidad de la mezcla de reacción, T es la temperatura absoluta del sistema en Kelvin, A es el factor preexponencial de la reacción química, Ea es la energía de activación de la reacción y R es la constante universal de los gases . Considerando las unidades del factor preexponencial A en esta ecuación, es idéntica a las unidades de las constantes de velocidad, que dependen del orden de la reacción. Por ejemplo, si la respuesta es de primer orden, entonces las unidades de A por segundo (ver-1). En otras palabras, en esta respuesta, A es el número de colisiones por segundo que ocurren en la orientación correcta. Además, esta relación describe que tanto el aumento de la temperatura como la disminución de la energía de activación conducen a un aumento de la velocidad de reacción.

Figura 01: Varias derivaciones de la ecuación de Arrhenius
¿Qué ecuación de Eyring?
La ecuación de Eyring es una ecuación que describe los cambios en la velocidad de una reacción química en función de la temperatura de la mezcla de reacción. Esta ecuación fue desarrollada en 1935 por Henry Eyring junto con otros dos científicos. La ecuación de Eyring es similar a la ecuación de Arrhenius cuando se considera una entalpía de activación constante y una entropía de activación constante. La fórmula general de la ecuación de Eyring es la siguiente:

donde ΔG‡ es la energía de activación de Gibbs, κ es el coeficiente de transmisión, kB es la constante de Boltzmann y h es la constante de Planck.
¿Cuál es la diferencia entre las ecuaciones de Arrhenius y Eyring?
Las ecuaciones de Arrhenius y Eyring son ecuaciones importantes en química física. La principal diferencia entre la ecuación de Arrhenius y la de Eyring es que la ecuación de Arrhenius es una ecuación empírica, mientras que la ecuación de Eyring se basa en el razonamiento estadístico-mecánico. Además, la ecuación de Arrhenius se usa para modelar el cambio de temperatura de los coeficientes de difusión, la ocupación de vacantes de cristal, las tasas de fluencia y muchos otros procesos inducidos térmicamente, mientras que la ecuación de Eyring es útil en la teoría del estado de transición, donde se conoce como teoría del complejo activado.
Resumen: Arrhenius frente a la ecuación de Eyring
Las ecuaciones de Arrhenius y Eyring son ecuaciones importantes en química física. La principal diferencia entre la ecuación de Arrhenius y la de Eyring es que la ecuación de Arrhenius es una ecuación empírica, mientras que la ecuación de Eyring se basa en el razonamiento estadístico-mecánico. La ecuación de Arrhenius se utiliza para modelar la variación de temperatura de los coeficientes de difusión, la ocupación de vacantes de cristal, las tasas de fluencia y muchos otros procesos inducidos térmicamente. La ecuación de Eyring, por otro lado, es útil en la teoría del estado de transición, donde se conoce como teoría del complejo activado.
Relación:
1. "6.2.3.1: Ecuación de Arrhenius". Chemistry LibreTexts, Libretexts, 11 de septiembre de 2020, disponible aquí.
2. "Ecuación de Eyring". WikipediaFundación Wikimedia, 16 de octubre de 2020, disponible aquí.
Imagen de cortesía:
1. "ArrheniusMundim nuevo" Por Kleber Carlos Mundim - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia





Deja una respuesta