
¿Qué es el platino?
Platino es un elemento químico o metal maleable de alta densidad, brillante, blanco plateado del grupo 10 de la tabla periódica con número atómico 78 y símbolo pt. Químicamente, el platino metálico es inerte al ataque de ácidos minerales, aire o agua en condiciones normales. Es más maleable que el oro, la plata o el cobre, pero menos maleable que el oro.
Los elementos a saber, rutenio, rodio, paladio, osmio, iridio y platino se denominan metales de platino. Todos estos elementos son raros en la corteza terrestre. Los metales de platino se encuentran junto con otros metales preciosos como el cobre, la plata y el oro.
Historia del platino
El platino se encontró en la tumba de la reina Shapenapit en el siglo VII. En 1748, las expediciones españolas Antonio de Ulloa conservaron ciertos minerales que contenían metales con un punto de fusión muy alto. Se llamaba platino (pequeña plata en español)
Un estudio posterior de H Scheffer, Von Sickingen y P Charbonneau desarrolló el proceso de aislamiento y el nombre del metal platino.
Propiedades del platino
En general, los metales de platino tienen un alto punto de fusión y una alta densidad.
La entrada gradual de electrones de protección o núcleo interno de electrones (n-1) es responsable de la disminución lenta del punto de fusión y la densidad junto con las matrices horizontales de Re a Pt.
| metal platino | Densidad (g/cm3) | Punto de ebullición (°C) |
| tu | 12.45 | 2334 |
| Rh | 12.41 | 1964 |
| p.d. | 12,023 | 1554 |
| Os | 22.59 | 3033 |
| ir | 22.56 | 2446 |
| punto | 21.45 | 1768 |
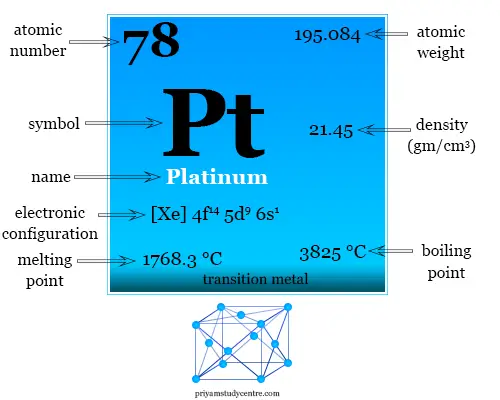
La configuración electrónica y algunas propiedades físicas y químicas del platino se dan debajo de la tabla,
| Propiedades | |
| número atómico | 78 |
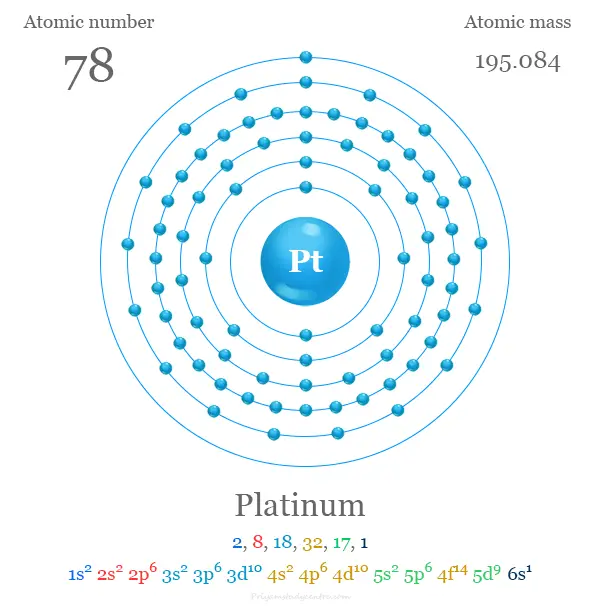
| Configuración electrónica | [Xe] 4f14 5d9 6s1 |
| Peso atomico | 195,084 |
| Punto de fusion | 1768,3 ºC |
| Punto de ebullición | 3825 °C |
| Espesor | 21,45 g/cm23 |
| Capacidad calorífica molar | 25,86 J mol−1 k−1 |
| Resistencia eléctrica | 105 nΩ·m |
| estructura cristalina | red cristalina cúbica centrada en las caras (fcc) |
| Grupo | 10 |
| Período de tiempo | 6 |
| Bloquear | bloque d |
| Propiedades químicas | |
| número de oxidación | +2, +4 |
| Electronegatividad | 2.28 (escala de Pauling) |
| Energía de ionización | 1º: 870 kJ/mol 2º: 1791 kJ/mol |
De los elementos del grupo 10, como Ni, Pd y Pt, la energía de ionización aumenta al aumentar el número atómico. Debido a la construcción de los lantánidos, el radio atómico de Pd y Pt es el mismo.
Platino en la tabla periódica
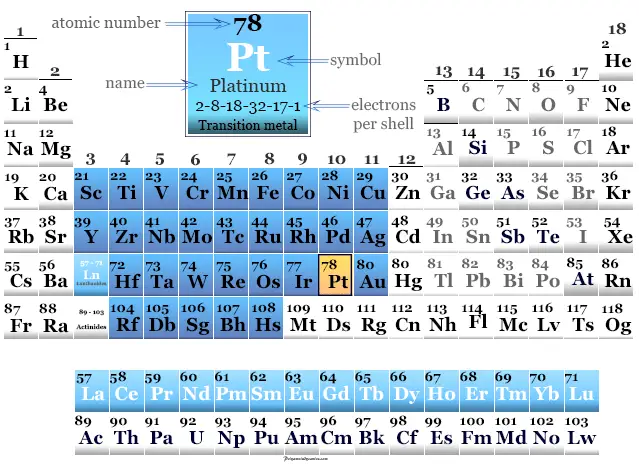
Se coloca en el grupo 10 de la tabla periódica con elementos de bloque d o metales de transición. La configuración electrónica de la capa de valencia de platino es: [Xe] 4f14 5d9 6s1.
Tiene muchas similitudes con el miembro del grupo paladio. El número o estado de oxidación +2 y +4 es el más común para ambos metales.
¿Dónde se encuentra el platino?
Las principales fuentes de platino son Sudáfrica, Canadá, Rusia, Brasil, Colombia, etc. Es raro en la corteza terrestre y se encuentra alrededor de 0,01 ppm. El metal se encuentra generalmente junto con sulfuro y arseniuros de Cu, Ag y Au.
Braggiete (Pd, Pt, Ni)S, Sperrylita (PtAs2) y trabajar juntos (PtS) son los minerales más comunes del platino metálico. Un metal nativo también está disponible en el medio ambiente de la Tierra.
Proceso de producción
Los metales de platino generalmente se extraen del mineral de cobre o níquel. En la producción de cobre o níquel, el lodo del ánodo contiene metales de platino junto con Ag y Au. El platino se recoge del lodo del ánodo mediante el tratamiento con agua regia. La solución contiene complejos de cloro soluble como HAuCl4¿eh?2PdCl4y H2PtCl6.
- De la solución, el oro es precipitado por FeSO4.
- La solución con PdCl4−2 y PtCl6−2 se trata con NH4Precipitado Cl (NH4)2PtCl6. Se enciende para obtener platino esponjoso impuro.
- Se vuelve a disolver en agua regia y se evapora la solución con cloruro de sodio. De la solución, Na2PtCl6 Esta recibido. Si contiene Rh o Ir, eliminarlo con NaBrO. agregar3.
- (NUEVA HAMPSHIRE4)2PtCl6 ahora se precipita de nuevo mediante la adición de NH4Cl y se enciende para producir platino metálico.
Uso de metal platino
- Se utiliza en gran medida como catalizador químico en varios tipos de reacciones químicas.
- Se utiliza en el reformado de hidrocarburos, oxidación de amoníaco a NO y oxidación de dióxido de azufre (SO2) a trióxido de azufre (SO3).
- Pt también se usa para fabricar equipos de laboratorio como crisoles, botes, etc.
- Se utiliza para la fabricación de electrodomésticos y alambre de resistencia.
- Los electrodos de platino se utilizan para medir la conductividad y las celdas electroquímicas.
- Actualmente, se utiliza en gran medida en convertidores de escape de automóviles para reducir la proporción de contaminación.
- Cis-Pt(NH3)2kl2 (cisplatino) es un fármaco antitumoral eficaz utilizado en la quimioterapia del cáncer. Se ha informado una tasa de éxito muy alta con el uso de Cis-Pt (NH .)3)2kl2 en el tratamiento de tumores sólidos, en particular tratamiento urogenital.
- Una cantidad significativa de platino se usa para hacer joyas.
Ingredientes químicos
Los estados de oxidación +4 y +2 son los estados de oxidación más comunes del Pt. Solo unos pocos compuestos químicos se forman en los estados +6 y +5. A continuación se analizan algunos compuestos químicos comunes del platino metálico en diferentes estados de oxidación.
hexafluoruro de platino
El hexafluoruro (PtF6) es el representante del platino metálico en el estado de oxidación +6. Es un sólido inestable volátil de color rojo oscuro.
PtF6 es un reactivo altamente reactivo y corrosivo que reacciona con el vidrio cuando está seco. Por lo tanto, a PtF. para tratar6, utilizamos dispositivos hechos de metal Monel. PtF6 es el agente oxidante más poderoso que oxida el oxígeno y el xenón a O2+PtF6 y Xe(PtF6)norte.
Cloruro de platino (IV)
Forma los cuatro tetrahaluros. Bronceado PtF4 se obtiene por fluoración del platino metálico. Otros tetrahaluros se obtienen por reacción directa de Pt con cloro, bromo o yodo.
El tetracloruro (PtCl4) suele ser preparado por H. calentar2PtCl6 en cl2 a 300°C. También se prepara haciendo reaccionar el Pt con SO2kl2. El sólido cristalino marrón rojizo, PtCl4 disuelto en agua para dar iones con la composición [PtCl4(OH)2]−2.
Cloruro de Pt(II)
El cloruro de platino (II) se obtiene por descomposición térmica de PtCl4. PtCl2 forma compuestos de grupos metálicos con la fórmula Pt6kl12. en el pt6kl12 estructura, los seis átomos de platino ocupan las seis puntas del octaedro y las doce aristas del octaedro contienen doce átomos de cloro conectados.
ácido clorplatínico
El ácido cloroplatínico o hexacloroplatinato de dihidrógeno (IV) es un compuesto importante de platino metálico con la fórmula molecular H2[PtCl6]. Se obtiene disolviendo Pt en agua regia. Evaporación de la solución de ácido clorhídrico para eliminar el ácido nítrico.
2HNO3 + 8 HCl + Pt → H2[PtCl6] + 2 NOCl + 4 H2O
El ácido cloroplatínico es un ácido fuerte, forma sales alcalinas o de amonio cuando reacciona con hidróxido alcalino o de amonio.
Complejos de platino (IV)
Pt(IV) forma un gran número de complejos octaédricos que son estables e inertes a la sustitución. Muchos de estos se obtienen fácilmente agregando ligandos en complejos de Pt(II).
puntoYoyo4 + hermano2 → trans-PTL4hermano2
Toda la gama de complejos de Pt(IV) que van desde [Pt(am)6]+4 (am = amoníaco o una variedad de aminas) a [PtX6]−2donde, X = halógeno, OH, SNC, NO2etc.
Los ejemplos más comunes son,
- [Pt(NH3)6]kl4
- [Pt(NH3)5Cl]kl3
- [Pt(NH3)4Cl2]kl2
- [Pt(NH3)3Cl3]kl3
- k2[PtCl6]
Complejos de platino (II)
Una solución de K. sacudir2PtCl4 en HCl diluido y etileno (C2¿eh?4) da el complejo K[PtCl3(C2H4)] o las sales de Zeise. cis y trans [Pt(NH3)2Cl2] son los ejemplos más comunes de complejos de Pt(II).
La sal verde de Magnus es otro complejo de Pt(II) con la fórmula de [Pt(NH3)4][PtCl4]. Esta sal de platino se prepara añadiendo complejo rosa [PtCl4]−2 a incoloro [Pt(NH3)4]+2.














Deja una respuesta