Neón en la tabla periódica
Neón (símbolo Ne), elemento químico, gas inerte o gas noble del grupo 18 de la tabla periódica descubierto por sus propiedades físicas como el espectro electromagnético. El gas de neón monoatómico incoloro, inodoro e insípido se usa ampliamente en lámparas fluorescentes. Ocurre hasta 18 ppm por volumen en aire seco y 5 × 10−5 ppm por peso en rocas ígneas.
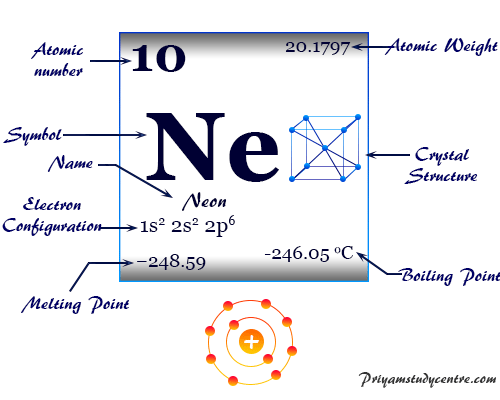
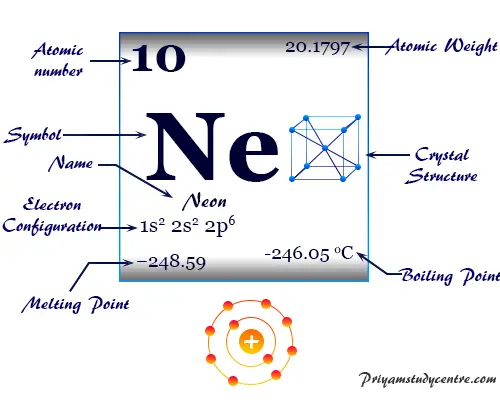
El nombre del gas más ligero, neón, deriva del griego neos, que significa nuevo. En estado sólido forma una red cristalina cúbica centrada en las caras.
¿Quién descubrió el neón?
El filósofo natural y científico inglés Henry Candavis 1785 notó que la pequeña muestra de aire en la atmósfera contiene una pequeña cantidad de gas (1/120 parte) incluso después de repetidas chispas con exceso de oxígeno.
En 1898, los químicos británicos Sir William Ramsay y Morris W. Travers descubrieron tres nuevos elementos como el neón, el criptón y el xenón de las palabras griegas nuevo, oculto y extraño al destilar aire líquido a baja temperatura.
Propiedades del neón
El gas inerte, neón, tiene el símbolo químico Ne, el número atómico 10 y una relación de capacidad calorífica (Cp/Cv) de casi 1,66. Debido al orbital de valencia lleno, el número de oxidación o estado de oxidación es cero.
| Nombre | Neón |
| Símbolo | no |
| Descubrimiento | Sir William Ramsay y Morris Travers en 1898 |
| Nombre derivado de | El griego 'neos' significa nuevo |
| Propiedades del neón | |
| número atómico | 10 |
| Peso atomico | 20.1797 |
| electrón por escala | 2, 8 |
| Configuración electrónica | [He] 2s2 2p6 |
| Grupo | 18 |
| Período de tiempo | 2 |
| Bloquear | bloque p |
| isótopo común | 20no |
| Se mantiene a 20°C | Gas |
| Punto de fusion | -248,59 °C, -415,46 °F |
| Punto de ebullición | -246,046 °C, -40,883 °F |
| Espesor | 0,89990 g/litro a 1 atm |
| Punto crítico | 44,4918 K, 2,7686 MPa |
| Capacidad calorífica molar | 20,79 J mol−1 k−1 |
| Estados de oxidación | 0 |
| Radio atómico (sin consolidar) | 1.54 |
| Radio covalente | 0,62 |
| Afinidad electrónica (kJ mol−1) | Desconocido |
| Electronegatividad | Desconocido |
| Energía de ionización | 1º: 2080,7 kJ/mol |
| 2º: 3952,3 kJ/mol | |
| 3º: 6122 kJ/mol | |
| número CAS | 7440-01-9 |
¿Dónde se encuentra el neón?
Se encuentra a 18 ppm por volumen en aire seco y 7 × 10−5 ppm por peso en rocas ígneas. Al igual que otros gases nobles (helio, argón, criptón), el neón se obtiene principalmente como subproducto de la licuefacción del aire.
Los gases nobles también se pueden fraccionar de manera efectiva mediante su adsorción preferencial en carbón vegetal a temperaturas preferidas. A -180 °C, el carbón adsorbió argón, criptón, xenón y radón. La desparasitación del carbón a -80°C produjo argón casi puro. Después de la adsorción de Ar y gases nobles más pesados, el Ne y He más ligeros se adsorben a -225 °C.
isótopos
El neón tiene tres isótopos estables, 20No (90,92 por ciento), 21Ne (0.26 por ciento), y 23No (8,82 por ciento). También se obtuvieron 17 isótopos radiactivos a partir de diferentes tipos de reacciones nucleares o reacciones termonucleares.
Ingredientes químicos
El neón es el segundo gas noble más ligero después del helio y contiene subcapas s y p de valencia completa para hacer una configuración muy estable. La energía requerida para la promoción de un electrón a los próximos orbitales vacíos es bastante grande.
Este hecho sugiere que el enlace covalente del gas es muy desfavorable. La formación de compuestos iónicos por enlace químico con flúor es poco probable debido a la alta entropía positiva y energía libre para la formación de compuestos iónicos. Por lo tanto, no se han observado compuestos químicos estables de Ne y la molécula del elemento consta de pocos átomos.
Reactividad de neón
El hidrato de clatrato sólido se produjo a partir de hielo de agua y gas neón a altas presiones y una temperatura de -30 ° C. El clatrato no puede llamarse un compuesto verdadero, ya que está unido por enlaces de hidrógeno. Las moléculas de gas noble se mueven libremente a través de los materiales. Cuando se calienta, el gas se libera.
La energía de ionización es máxima para todos los gases nobles de la tabla periódica, pero disminuyen en el grupo. Los hechos indican que si los gases nobles muestran alguna reactividad, están presentes en la posición inferior del grupo.
¿Para qué sirve el neón?

- Es ampliamente utilizado en electrónica para el llenado de células fotoeléctricas, estabilizadores de voltaje, tubos de vacío, indicadores de alto voltaje, tubos medidores de ondas, tubos de televisión, láseres de helio-neón e instrumentos similares.
- Las llamadas luces de neón o luz rojo-naranja brillante en los anuncios contienen una mezcla de gases nobles que se utilizan en los diferentes colores de luz fluorescente.
- Es un no conductor de electricidad, pero bajo baja presión y alto voltaje comienza a conducir. En estas condiciones, tiene lugar la ionización de los átomos.
- El ion abandonado, al volver a su estado fundamental, emite una luz anaranjada rojiza característica que se utiliza en laminillas de conducción o tablas de tablero.
- El neón líquido se utiliza como refrigerante criogénico para enfriar moléculas de gas helio. Es más caro que las otras sustancias licuadas. Por lo tanto, debido al alto precio del gas neón, no podemos ser utilizados para lograr temperaturas más bajas como el nitrógeno líquido o el helio.