
¿Qué es el Manganeso?
Manganeso es un elemento químico o un metal de transición paramagnético quebradizo, duro de color blanco grisáceo del Grupo 7 (VIIB) de la tabla periódica con el símbolo Mn y número atómico 25. Se utiliza principalmente como aditivo para el acero.
El químico sueco Bergmann descubrió la presencia de manganeso en el óxido de magnesio negro, pero no pudo aislarlo. En química, el elemento fue aislado por otro químico sueco Johan Gottlieb Gahn y estudiado en 1774 por el químico sueco Carl Wilhelm Scheele.
El metal recibió su nombre en latín magnesio del antiguo nombre pirolusita.
Propiedades del manganeso
Formó una red cristalina cúbica centrada en el cuerpo. El punto de fusión y la densidad del manganeso son mucho más bajos que los del cromo, lo que indica una mayor participación del electrón d en el enlace químico metálico.
Conocemos el número o estado de oxidación +6 en el permanganato de potasio compuesto, KMnO4un fuerte agente oxidante.
| Manganeso | |||
| Símbolo | Minnesota | ||
| Descubrimiento | Johan Gottlieb Gahn en 1774 | ||
| Nombre derivado de | El latín magnes significa imán o del óxido de magnesio negro magnesia nigra | ||
| isótopo común | 55Minnesota | ||
| Estados de oxidación | −3, −2, −1, 0, +1, +2, +3, +4+5, +6, +7 | ||
| número CAS | 7439-96-5 | ||
| Propiedades periódicas | |||
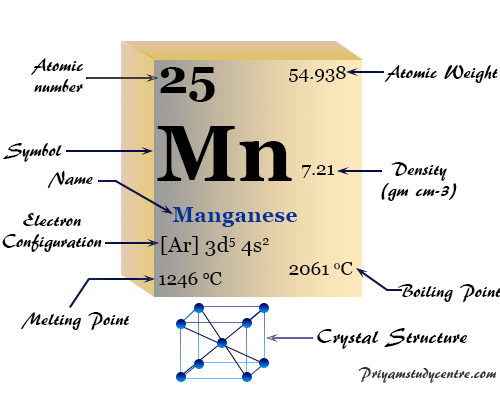
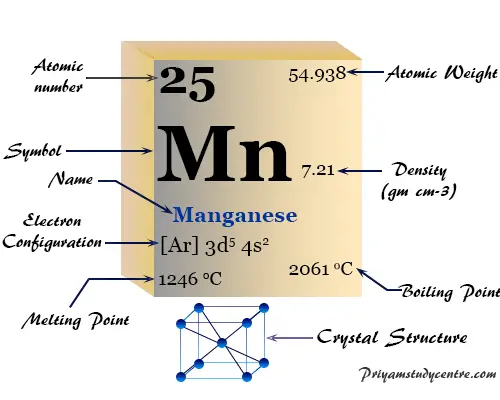
| número atómico | 25 | ||
| Masa atómica relativa | 54,938 | ||
| electrón por celda | 2, 8, 13, 2 | ||
| Configuración electrónica | [Ar] 3d5 4s2 | ||
| Bloquear | bloque d | ||
| Grupo | 7 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1246°C, 2275°F, 1519K | ||
| Punto de ebullición | 2061°C, 3742°F, 2334K | ||
| Capacidad calorífica molar | 26,32 J mol−1 k1 | ||
| estructura cristalina | cúbico centrado en el cuerpo (bcc) | ||
| Espesor | 7,3 g/cm23 | ||
| El calor de la fusión | 12,91 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.05 | ||
| Radio covalente | 1.29 | ||
| Electronegatividad | 1,55 (escala de Pauling) | ||
| Afinidad electronica | Desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 717.27 | 1509.03 | 3248.47 | |
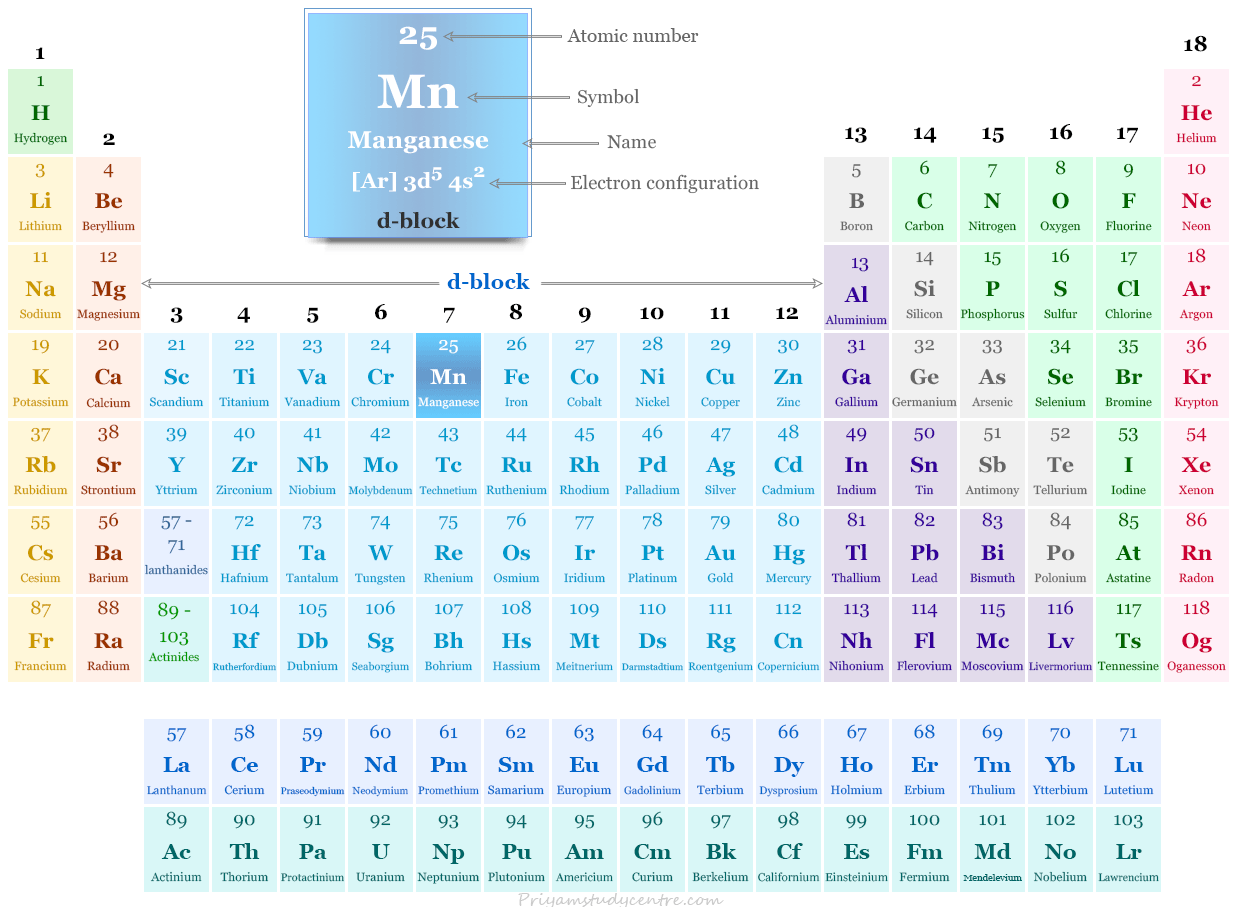
Manganeso en la tabla periódica
Se coloca en el grupo 7 y el período 4 con elementos de bloque d en la tabla periódica. El manganeso es un miembro de un metal de transición que posee la configuración electrónica orbital más externa. [Ar] 3d5 4s2.
¿Dónde se encuentra el manganeso?
Es el tercer metal de transición más abundante después del hierro y el titanio y el duodécimo elemento más abundante de todos los elementos de la tabla periódica. Ocurre 1000 ppm en la corteza terrestre.
El manganeso se encuentra en una variedad de minerales como la pirolusita (MnO2) Hausmannita (Mn3O4), Braunite (Mn2O3) Abeto de manganeso (MnCO3) en Rusia, India, Sudáfrica, Ghana, Brasil y Chile.
Las partículas coloidales de manganeso se encuentran en el fondo del océano para formar nódulos compactos de manganeso. Contiene de 15 a 30 por ciento de metal en base seca con cobre, níquel y cobalto. Más de 1012 ya se han recolectado notas de tales nódulos del fondo del océano. El gran depósito de los elementos puede adquirir importancia comercial en el futuro.
El elemento de transición manganeso está presente en plantas alimenticias y cuerpos animales y juega un papel importante en el proceso biológico.
Isótopos del elemento
El manganeso natural tiene un isótopo estable con una masa atómica de 55. Tiene varios isótopos radiactivos con una masa atómica de 44 a 69.
Los isótopos radiactivos de Mn se obtienen a partir de diferentes tipos de reacciones nucleares. 55Mn (vida media = 3,7 millones de años) y 54Mn (vida media = 312,2 días) son los isótopos más estables de Mn.
Proceso de producción
El elemento manganeso se produce por electrólisis de una solución acuosa de sulfato de Mn(II) que se prepara a partir de pirolusita calentando ácido sulfúrico concentrado a 150°C.
Alternativamente, la pirolusita se calienta por debajo de 800°C con vitriolo verde deshidratado. En ambas técnicas, el sulfato de manganeso (MnSO4) se lixivia del residuo dejando impurezas como óxido de hierro y otros compuestos de silicato.
El sulfato de Mn(II) se purificó adicionalmente por cristalización antes de someterlo a electrólisis.
Ingredientes químicos
El metal paramagnético de color blanco grisáceo, el manganeso, no se oxida en forma muy pura, pero la presencia de impurezas como el carbono lo hace más reactivo.
Liberó hidrógeno de todos los ácidos diluidos, incluido el ácido nítrico diluido. Los ácidos se reducen a dióxido de azufre y monóxido de nitrógeno (NO).
El estado de oxidación +2 es más estable debido a la presencia de un semi-lleno d5 configuración electronica. El diagrama del estado de oxidación del potencial de reducción sugiere que el Mn(VI) es un agente oxidante fuerte, que se oxida para formar iones Mn(III) y Mn(IV).
Permanganato de potasio
El permanganato de potasio es un compuesto importante de manganeso con la fórmula química KMnO4. El permanganato es conocido por sus fuertes propiedades oxidantes.
El ion permanganato es un agente oxidante muy fuerte en solución ácida y moderadamente fuerte en medio neutro y alcalino. El permanganato de potasio se utiliza como agente oxidante en química analítica.
En el estado +7, el metal forma óxido como Mn2O7 y oxohalogenuros MnO3Cl y MnO3F. El óxido verde es altamente explosivo y encenderá el alcohol o el éter al contacto.
ion manganato
Ion manganato (MnO4−2) es el único representante adecuado en el estado +6 de manganeso.
Se obtiene como una masa verde fusionando pirolusita con álcali. La masa verde se extrae con agua que contiene poco álcali y la solución se evapora a un sólido cristalino verde oscuro K. entregar2MnO4.
Óxido de manganeso (IV)
En el estado +4, el manganeso forma de forma estable dióxido de MnO2haluro MnF4y los complejos MnX6−2donde X = flúor, cloro, cianuro e IO3.
Pirolusita o MnO2, un mineral común presente en la corteza terrestre, es la fuente principal del metal manganeso. Es un sólido marrón-negro claro que es mayormente insoluble en agua e inerte a los ácidos fríos.
El ácido clorhídrico y el ácido sulfúrico o nítrico concentrado calentado son oxidados por MnO2. El dióxido de manganeso es un compuesto importante de Mn, una industria del vidrio ampliamente utilizada para decolorar el vidrio y en la fabricación de cajas de fósforos.
Compuestos de manganeso (II)
El estado +2 es el estado de oxidación más abundante y estable del manganeso para formar una gran cantidad de compuestos binarios (óxidos, haluros) y complejos.
El óxido, MnO, se prepara con MnO. para obtener2 con hidrógeno o adscripción MnCO3 con hidrógeno o nitrógeno. Se oxida fácilmente en el aire a temperatura normal a Mn. Dar forma2O3 o manganeso2O4.
Los cuatro haluros de manganeso con la fórmula química MnX2 son compuestos estables e isomorfos a los haluros de magnesio. Los haluros se preparan fácilmente con MnCO. responder3 con los hidrácidos correctos de flúor, cloro, bromo y yodo.
Complejos de metales de transición
En química, el manganeso (II) forma una amplia gama de compuestos complejos con diferentes tipos de estereoquímica. El d5 La configuración del manganeso no proporciona energía de estabilización de campo cristalino (CFSE) en complejos octaédricos y tetraédricos de alto espín.
En el estado de oxidación +2, forma complejos octaédricos estables de alto espín por amoníaco, EDTA, oxalato, etilendiamina y SCN..
Las constantes de equilibrio químico para la formación de estos iones a partir de iones de agua son muy bajas, lo que nuevamente puede atribuirse a la falta de ganancia en CFSE.
uso de manganeso
Uso de acero al manganeso
El elemento de transición, el manganeso, se utiliza principalmente como aditivo para la fabricación de acero. El manganeso se combina con el azufre presente en el acero, lo que evita la formación de materiales frágiles como el FeS.
- Las aleaciones de acero que contienen de 70 a 80 por ciento de manganeso se conocen como ferro-manganeso.
- 15 a 20 por ciento de metal se llama requisitos de espejo.
Debido a su alta resistencia, las aleaciones de manganeso tienen una gran demanda industrial y se utilizan para fabricar vías férreas, bóvedas, cañones de armas, trituradoras, barras de perforación y barras de prisión.
La otra aleación que contiene del 17 al 19 por ciento de cromo, del 8 al 10 por ciento de manganeso, del 0,75 al 1 por ciento de cobre y pequeñas cantidades de carbono y silicio tiene una alta resistencia a la corrosión y al ataque químico.
Uso común
- Varias aleaciones que no son de acero, como las aleaciones de manganeso y bronce, se utilizan para fabricar palas de hélice y manganina en instrumentos eléctricos debido a su resistencia eléctrica.
- El manganeso y sus compuestos se utilizan ampliamente como catalizador químico.
- También se utiliza en las industrias de suplementos farmacéuticos, fertilizantes y vidrio como agente decolorante.
- En las celdas electroquímicas o celdas secas, el manganeso se utiliza como despolarizador.














Deja una respuesta