
Elemento Magnesio
Magnesio es un elemento químico, metal alcalinotérreo del Grupo 2 (IIA) de la tabla periódica con símbolo Mg y número atómico 12. Es un metal esencial que regula cientos de reacciones químicas en nuestro cuerpo para una buena salud.

Es muy utilizado en construcciones ligeras. En la red cristalina empaquetada cerrada hexagonal, el magnesio es un metal blanco plateado, brillante y relativamente blando. La química del magnesio se caracteriza por el tamaño pequeño y, en consecuencia, la fuerte polarización eléctrica del Mg.+2 ion.
Propiedades del magnesio
Es mucho más duro que los metales alcalinos debido al uso de dos electrones para el enlace químico. La energía de ionización también es mucho mayor que la del berilio. Esto se debe principalmente a que el tamaño de Mg+2 mucho más alto que el de Be+2.
La tercera energía de ionización del Mg y otros metales alcalinotérreos es mucho mayor debido a la configuración electrónica de capa cerrada como el M+2 ion.
| Magnesio | |||
| Símbolo | miligramos | ||
| Descubrimiento | José Negro en 1755 | ||
| Nombre derivado de | Un distrito del este de Tesalia en Grecia | ||
| isótopo común | 12miligramos24 | ||
| número de oxidación o estado | +2 | ||
| número CAS | 7439-95-4 | ||
| Propiedades periódicas | |||
| número atómico | 12 | ||
| Peso atomico | 24.305 | ||
| electrón por celda | 2, 8, 2 | ||
| Configuración electrónica | [Ne] 3s2 | ||
| Bloquear | bloque s | ||
| Grupo | 2 | ||
| Período de tiempo | 3 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 923K (650 °C, 1202 °F) | ||
| Punto de ebullición | 1363 K (1091 °C, 1994 °F) | ||
| Capacidad calorífica molar | 24.869 J mol−1 k1 | ||
| estructura cristalina | empaquetado cerrado hexagonal (hcp) | ||
| Espesor | 1,74 g/cm23 | ||
| Resistencia eléctrica | 43,9 nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 1.73 | ||
| Radio covalente | 1.40 | ||
| electronegatividad | 1.31 (escala de Pauling) | ||
| Afinidad electronica | Desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 737.75 | 1450.68 | 7732.69 | |
Magnesio en la tabla periódica
tiene un 3s2 configuración electrónica sobre un núcleo de gas noble. Esta configuración electrónica del metal magnesio conduce a su inclusión en el grupo 2 (IIA) en la familia alcalinotérrea de la tabla periódica. Por lo general, pierde dos s2 electrones para mostrar +2 número de oxidación o estado.
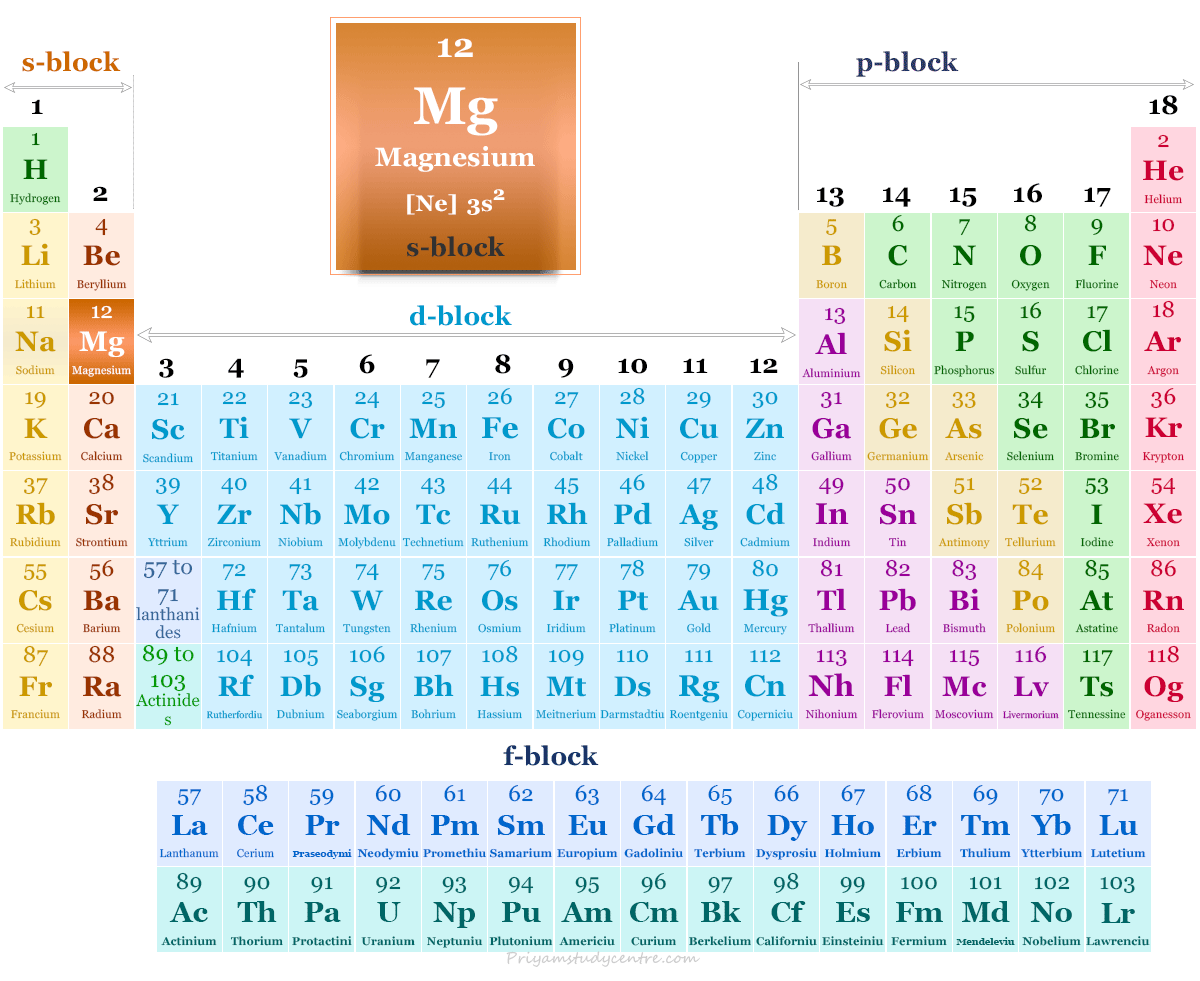
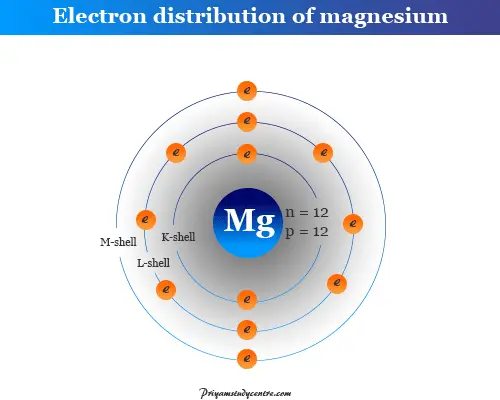
Estructura atómica del magnesio.
El número atómico del magnesio es 12 y su número de masa es 24. Por lo tanto, contiene 12 electrones, 12 protones y 12 neutrones en el núcleo. La distribución de estas partículas subatómicas se da debajo de la imagen,
¿Dónde se encuentra el magnesio?
El magnesio es un metal muy abundante que se encuentra en aproximadamente el 2,1 por ciento de la corteza terrestre. Ocurre principalmente como rocas sedimentarias como la dolomita (MgCO3 + CaCO3) y otras formas vaporizadas como la carnalita (KCl, MgCl26 horas2O).
El agua de mar contiene una enorme cantidad de magnesio (0,13 por ciento). La mayor parte del stock de metal ahora proviene del agua de mar. Una gran cantidad de metal se encuentra en el manto terrestre (olivino).
Magnesio en el cuerpo humano
El magnesio es el undécimo elemento más abundante en masa en el cuerpo humano que regula las reacciones biológicas de varios tipos de enzimas.
La clorofila de las plantas contiene Mg+2 iones Los compuestos son ampliamente utilizados en medicina, antiácidos y estabilizan la estimulación nerviosa anormal o la circulación sanguínea.
Proceso de producción
Se produce por electrólisis o reducción silicotérmica.
En el método electrolítico, la mezcla anhidra fundida de (MgCl2 + CaCl2 + NaCl) se electroliza a 750°C usando cátodo de hierro y ánodo de grafito en una atmósfera inerte.
En el proceso silicotérmico o el proceso Pidgeon, el óxido de magnesio o la dolomita calcinada (CaO, MgO) con ferrosilicio se calienta a aproximadamente 1150°C en un reactor de aleación de acero. Se mantiene un alto vacío para destilar el Mg formado por el proceso de fabricación.
Datos sobre el magnesio
Las propiedades del magnesio difieren de las del otro miembro del grupo en su comportamiento frente al amoníaco líquido.
- Los metales alcalinos, Ca, Sr y Ba se disuelven en amoníaco líquido para formar soluciones de color negro intenso.
- Pero Be y Mg no se disuelven fácilmente en amoníaco líquido. En una ebullición prolongada con amoníaco líquido, el hidrógeno evolucionó para formar una solución azul.
Ingredientes químicos
hidruro de magnesio
El hidruro de metal se obtiene por la combinación directa de magnesio con hidrógeno a 200 a 400°C.
Hidruro como CaH2SrH2y BaH2 se forma por enlace iónico pero BeH2 se forma por enlace covalente. Por lo tanto MgH2 tiene las propiedades para formar un intermediario entre esos enlaces iónicos y covalentes.
Óxido e Hidróxido de Magnesio
Un óxido como el MgO es un compuesto iónico con un alto punto de fusión. El óxido reacciona en agua para formar hidróxido.
Las propiedades básicas del hidróxido de metal alcalinotérreo aumentan de berilio a bario. El hidróxido de berilio es anfótero, pero todos los demás hidróxidos son de naturaleza básica.
haluros
Se combina con halógenos a una temperatura adecuada para formar dihaluro. Estos también se obtienen haciendo reaccionar el ácido hidrohálico con el metal o su óxido.
Sin embargo, el haluro de magnesio anhidro no se puede obtener simplemente calentando la solución acuosa debido a la hidrólisis. La reacción del halógeno sobre una mezcla de óxido de metal y carbono da un mejor método. Los haluros de magnesio anhidro se disuelven en ciertos solventes orgánicos como el alcohol, el éter y la cetona.
Compuestos organometálicos
Los dialquilos y diarilos de magnesio pueden obtenerse mediante la reacción de LiR o LiAr en el reactivo de Grignard en presencia de piridina a 100 °C.
magnesio + H2 + 2C2¿eh?4 → Gestión2
Los reactivos de Grignard (MgRX) son los compuestos organometálicos del metal más utilizados. Se hace mediante la adición lenta del haluro de alquilo o arilo a una suspensión agitada de magnesio metálico en éter u otros solventes. Tiene amplias aplicaciones en química orgánica sintética o de hidrocarburos.
¿Para qué sirve el magnesio?
- El magnesio es el tercer metal más utilizado después del hierro y el aluminio, y sus aleaciones se utilizan mucho en estructuras ligeras, como piezas de automóviles y aviones. La aleación generalmente se fabrica con 2 a 9 por ciento de aluminio, 1 a 3 por ciento de zinc y 0.1 a 1 por ciento de manganeso.
- Cada año se producen en todo el mundo más de 300.000 toneladas de metal para la fabricación de diversos tipos de materiales de construcción.
- Se utiliza como un buen y útil agente reductor.
- Las virutas de magnesio se utilizan para hacer UF. disminuir4 en reactores de acero revestidos de grafito para producir uranio metálico.
- Es un mineral importante que regula cientos de reacciones biológicas para la buena salud de nuestras vidas.
- Debido a su baja densidad y buenas propiedades mecánicas y eléctricas, el magnesio se utiliza en la producción de teléfonos móviles, ordenadores (portátiles y tabletas), cámaras y otros componentes electrónicos.
Función del magnesio en el cuerpo.
El magnesio es un elemento esencial para que el cuerpo humano controle varios tipos de funciones biológicas.
El 60 por ciento del Mg total del cuerpo humano adulto se distribuye en el esqueleto, mientras que el resto está presente en las células. el magnesio+2 ion en la célula siguiente catión más importante después de K+.
El pequeño catión doblemente cargado tiene una alta relación carga/tamaño. Está muy hidratado como [Mg(H2O)6]+2. El catión hidratado se une a la ROPO3Grupo H de nucleótidos (ATP, ADP) y polinucleótidos (ADN, ARN).
El ion puede formar complejos fuertes con átomos de oxígeno de diferentes grupos fosfato. Tales complejos son la fuente de energía para el cuerpo humano si es necesario.
La transmisión de impulsos nerviosos, el desarrollo muscular y el metabolismo de los carbohidratos también se ven afectados por el magnesio (Mg+2) iones y ácidos nucleicos.














Deja una respuesta