
¿Qué es el erbio?
erbio es un elemento químico o metal de tierras raras en la tabla periódica con el símbolo ejem y el número atómico 68. Es un elemento metálico plateado suave que se utiliza para fabricar fibras de vidrio óptico para amplificar las señales de comunicación óptica. El erbio también está aleado con vanadio para reducir la dureza y mejorar la trabajabilidad.

El erbio fue descubierto en 1843 por el químico sueco Carl Gustav Mosander a partir del mineral Ytterby en una mina de gadolinita encontrada en Suecia. Fue uno de los tres elementos encontrados en Ytterby que se separó del mineral gadolinita. Descubrió la forma de óxido del metal y lo llamó erbia en honor al pueblo de Ytterby.
¿Dónde se encuentra el erbio?
El erbio nunca se encuentra como un elemento libre en la naturaleza, pero se encuentra una cantidad extraíble en los minerales de tierras raras monacita y bastnaesita. Es una de las tierras raras más comunes extraídas principalmente en China y EE. UU.
Puede separarse o extraerse mediante cromatografía de intercambio iónico y extracción con disolvente.
isótopos
El erbio natural tiene seis isótopos estables con masas atómicas 162, 164, 166, 167, 168 y 170. También contiene 29 isótopos radiactivos sintéticos que pueden sintetizarse mediante diversas reacciones nucleares artificiales. La mayoría de estos isótopos radiactivos tienen una vida media de menos de 4 minutos.
El principal modo de desintegración radiactiva de estos isótopos radiactivos es la captura de electrones o desintegración beta.
Propiedades
El elemento erbio es un metal maleable de tierras raras de color blanco plateado que pertenece a la serie de los lantánidos en la tabla periódica. Al igual que otros lantánidos, generalmente exhibe un número o estado de oxidación de +3.
| erbio | |||
| Símbolo | ejem | ||
| Descubrimiento | Carl Gustavus Mosander en 1843 | ||
| Nombre derivado de | Lleva el nombre del mineral Ytterby encontrado en Suecia. | ||
| isótopo común | 68ejem166 | ||
| Condición de oxidación | +3 | ||
| número CAS | 7440-52-0 | ||
| Propiedades periódicas | |||
| número atómico | 68 | ||
| Masa atómica relativa | 167,259 | ||
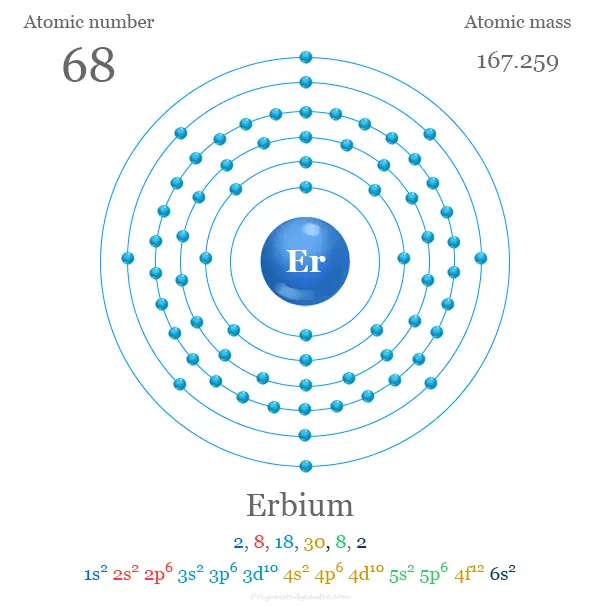
| electrón por celda | 2, 8, 18, 30, 8, 2 | ||
| Configuración electrónica | [Xe] 4f12 6s2 | ||
| Bloquear | bloque f | ||
| Grupo | lantánidos | ||
| Período de tiempo | 6 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1529°C, 1802K | ||
| Punto de ebullición | 2868°C, 3141K | ||
| Capacidad calorífica molar | 28,12 J mol−1 k1 | ||
| estructura cristalina | empaquetado cerrado hexagonal (hcp) | ||
| Espesor | 9,07 g/cm3 | ||
| Calor de fusión | 19,90 kJ mol−1 | ||
| Calor de evaporación | 280 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.29 | ||
| Radio covalente | 1.77 | ||
| Electronegatividad | 1,24 (escala de Pauling) | ||
| Afinidad electronica | Desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 589.30 | 1151.07 | 2194.08 | |
Configuración electrónica del erbio
Los 68 electrones del átomo de erbio se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica,
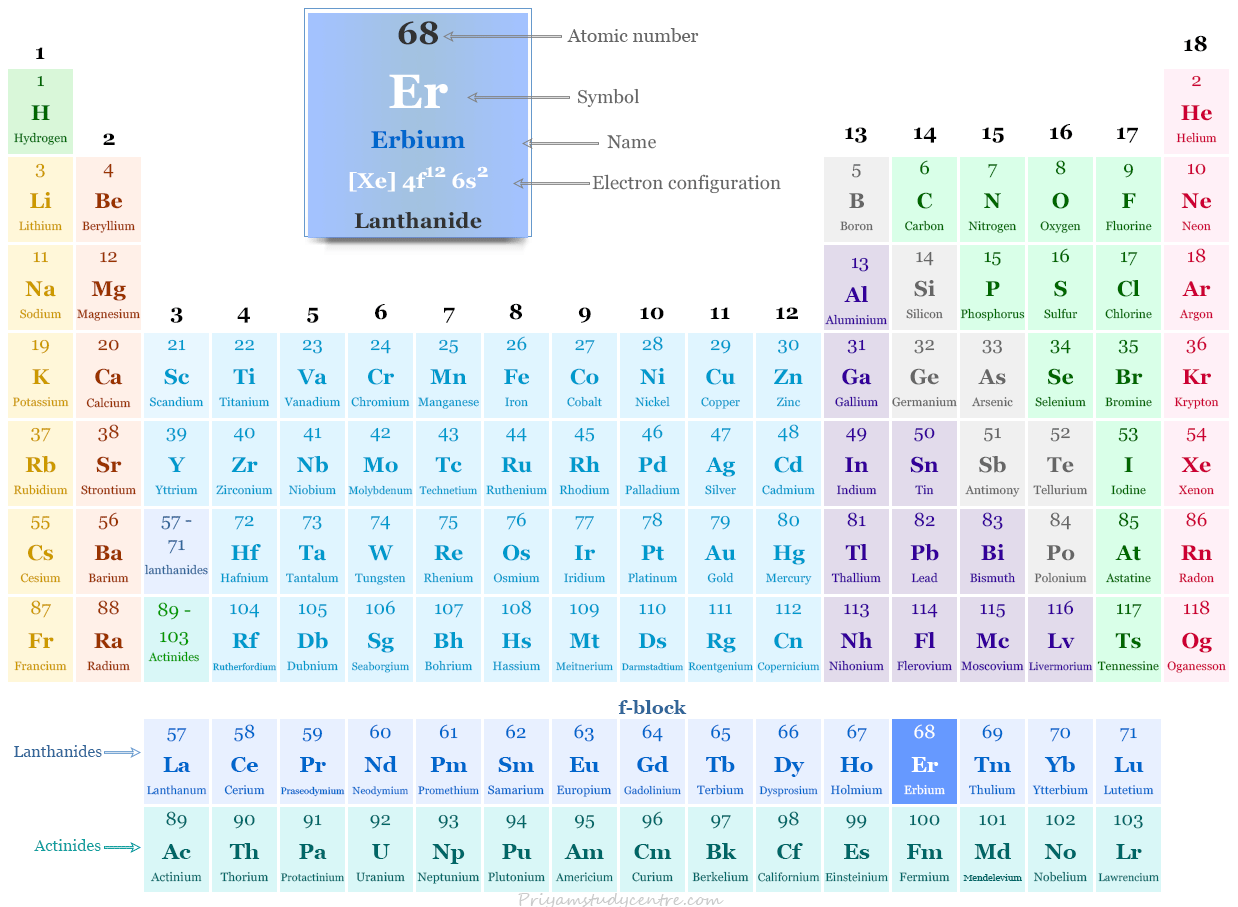
Erbio en la tabla periódica
El erbio, un metal de tierras raras, se coloca en el bloque f de la tabla periódica. Es el lantánido que se encuentra entre el holmio y el tulio.
Propiedades químicas
Es un metal reactivo que es muy estable en aire seco a temperaturas normales, pero se deslustra lentamente en atmósferas húmedas. Se quema en aire u oxígeno a óxido de erbio Er. Dar forma2O3.
4 Er + 3 O2 → 2 Er2O3
El metal de tierras raras Er está muy por encima del hidrógeno en la serie electroquímica. Por lo tanto, reacciona lentamente con agua fría y rápidamente con agua caliente liberando hidrógeno y formando hidróxido de erbio.
2 Er + 6 H2O → 2 Er(OH)3 + 3 horas2
Las reacciones con ácidos son más violentas, pero el Er no se disuelve en álcalis. Se disuelve fácilmente en ácido sulfúrico diluido para formar soluciones que contienen los iones Er(III) amarillos.
2 Er + 3 H2ASI QUE4 → 2 Er3+ + 3 SO4−2 + 3 horas2
Normalmente es de trihaluros con halógenos como flúor, cloro, bromo y yodo.
2 Er + 3 X2 (X = F, Cl, Br, I) → 2 ErX3
Datos sobre el erbio
- Nunca se encuentra en la naturaleza como elemento libre, sino junto con los minerales de otros elementos de tierras raras.
- El metal puro se aisló después del descubrimiento de la técnica de cromatografía de intercambio iónico.
- El precio estimado del erbio es de $650 por kilogramo. Después del descubrimiento de los avances en las técnicas de cromatografía de intercambio iónico, el precio bajó.
- Las sales de Er son compuestos de color rosa con espectros de adsorción nítidos en luz visible, ultravioleta e infrarroja.
- No muestra ningún papel biológico en los humanos, pero las sales de erbio pueden estimular el metabolismo en nuestro cuerpo.
- Las fibras ópticas dopadas con erbio pueden amplificar las señales en la tecnología de la comunicación.
- El metal puro es algo tóxico, mientras que los compuestos son en su mayoría de naturaleza no tóxica.
¿Para qué se usa el erbio?
- Está aleado con vanadio para reducir la dureza y mejorar la trabajabilidad.
- En la tecnología de la comunicación, los vidrios de sílice dopados con erbio se utilizan para fabricar fibras ópticas.
- El óxido de erbio de color rosa se utiliza para colorear vidrios, zirconia y porcelana.
- Se utiliza en cirugía láser debido a la longitud de onda única de los iones de erbio.
- La sal de Er aumenta el nivel de glóbulos rojos y de hemoglobina en la sangre.
- En la tecnología nuclear, el erbio se utiliza como material absorbente de neutrones en las barras de control de los reactores nucleares.
















Deja una respuesta