
¿Qué es el cesio?
cesio o cesio es un elemento químico o metal alcalino de la tabla periódica con el símbolo cs y número atómico 55. Es un metal del Grupo 1 de color amarillo dorado, blando y de bajo punto de fusión.

El cesio fue descubierto en 1860 por el químico alemán Robert Bunsen y el físico Gustav Kirchhoff. Se descubre a través del análisis de espectroscopia de llama.
Tiene un solo isótopo estable, Cs-133. El otro radioisótopo Cs-137 se recupera de los desechos del reactor nuclear.
¿Dónde se encuentra el cesio?
El cesio es un elemento relativamente raro que se encuentra en la corteza terrestre en un promedio de 3 ppm. Es el 45º elemento más abundante y el 36º de los metales presentes en la tabla periódica. Contiene más elementos que antimonio, cadmio, estaño, tungsteno, mercurio y plata.
Una cantidad muy pequeña de cesio metálico se encuentra en el mineral contaminado y lepidolita. La mina Tanco en Bernic Lake en Manitoba, Canadá, es la fuente más rica del mundo de mineral de cesio contaminante. Otra fuente comercial notable de contaminación por mineral de Cs se encuentra en Zimbabue y el desierto de Karibib, Namibia, EE. UU., etc.
isótopos
El cesio contiene 40 isótopos conocidos con números de masa de 112 a 151. El isótopo radiactivo 135Cs tiene una vida media muy larga de unos 2,3 millones de años.
El isótopo radiactivo 135Cs es uno de los productos de fisión de larga duración del uranio producido en los reactores nucleares. Casi todos los isótopos de cesio producidos por la fisión nuclear provienen de las reacciones de desintegración beta.
Cesio en la tabla periódica
El cesio se coloca en el grupo 1 y el período 6 en la tabla periódica. Es un metal alcalino que se encuentra entre el rubidio y el francio.
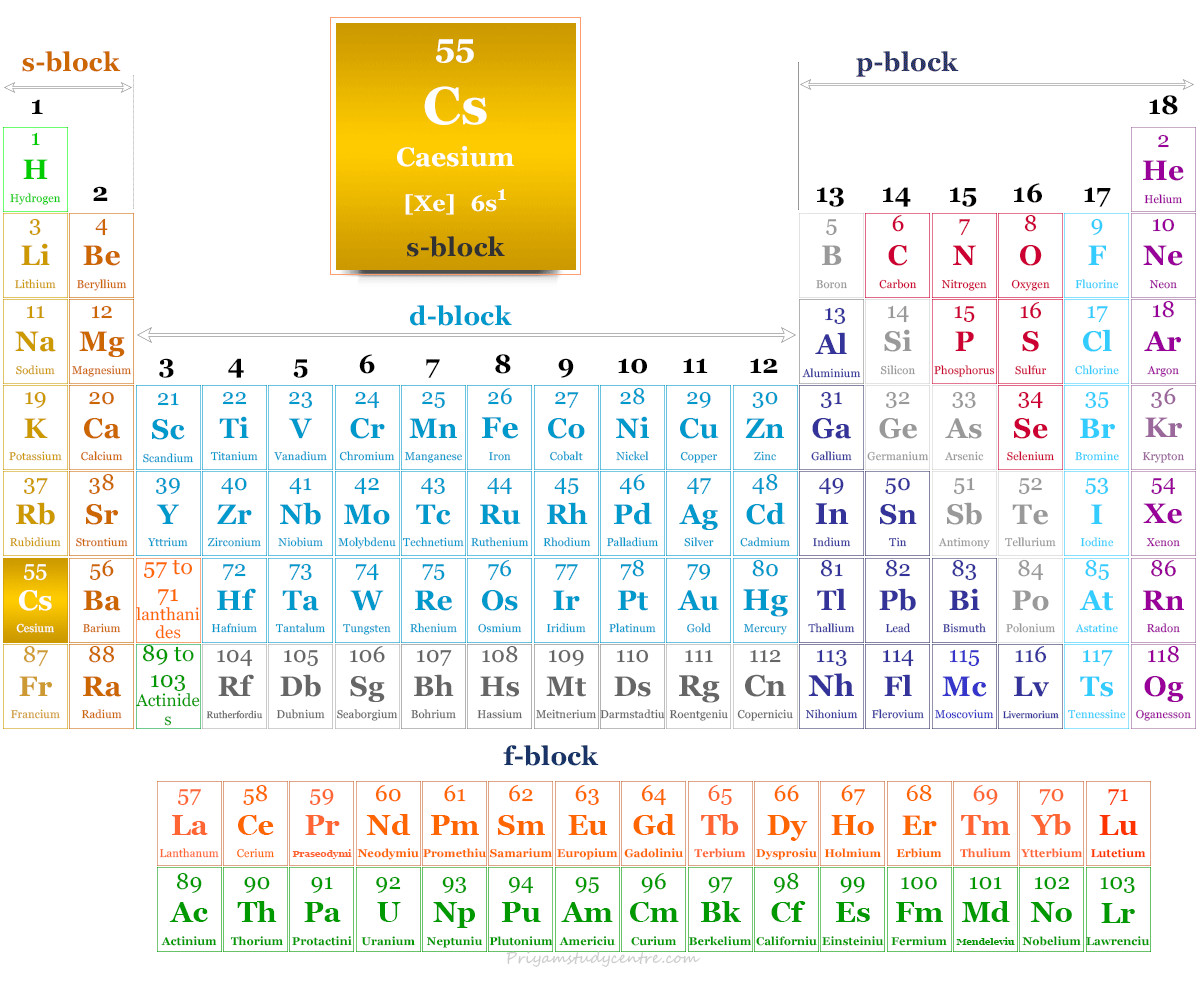
Propiedades
El cesio es un metal alcalino amarillo dorado suave de bajo punto de fusión que adopta una red cristalina cúbica en el centro.
La configuración electrónica de Cs es [Xe] 6s1. Al igual que otros metales alcalinos, solo un electrón participa en los enlaces metálicos. Hace que el metal sea suave y de bajo punto de fusión. Es el segundo metal de bajo punto de fusión después del mercurio.
| cesio | ||
| Símbolo | cs | |
| Descubrimiento | Gustav Kirchhoff y Robert Bunsen en 1860 | |
| Nombre derivado de | Palabra latina caesius que significa azul cielo y de su color de llama | |
| isótopo común | 55cs133 | |
| Estados de oxidación | −1, +1 | |
| número CAS | 7440-46-2 | |
| Propiedades periódicas | ||
| número atómico | 55 | |
| Masa atómica relativa | 132,905 | |
| electrón por celda | 2, 8, 18, 18, 8, 1 | |
| Configuración electrónica | [Xe] 6s1 | |
| Bloquear | bloque s | |
| Grupo | 1 | |
| Período de tiempo | 6 | |
| Características físicas | ||
| Condición a 20 °C | firma | |
| Punto de fusion | 28,5 °C, 83,3 °F, 301,7 K | |
| Punto de ebullición | 671°C, 1240°F, 944K | |
| Capacidad calorífica molar | 32,21 J mol−1 k1 | |
| estructura cristalina | cúbico centrado en el cuerpo (bcc) | |
| Espesor | 1.873 g/cm3 | |
| Resistencia eléctrica | 205 nm | |
| Propiedades atómicas | ||
| Radio atómico (sin consolidar) | 3.43 | |
| Radio covalente | 2.38 | |
| Electronegatividad | 0,79 (escala de Pauling) | |
| Afinidad electronica | 45.505 kJ mol−1 | |
| Energía de ionización (kJ/mol) | 1º | 2do |
| 375.70 | 2234.35 | |
El cesio forma aleaciones con otros metales alcalinos y metales de transición como el oro y el mercurio. A temperaturas inferiores a 650 °C, no forma aleaciones con cobalto, hierro, molibdeno, níquel, platino, tantalio o tungsteno.
Al igual que otros metales alcalinos, da una coloración de llama característica debido a la fácil excitación del electrón 6s. Cs da un color azul cuando se analiza con un fotómetro de llama o un espectrofotómetro de absorción atómica.
Reaccion quimica
El cesio metálico es altamente reactivo y se enciende espontáneamente en el aire. Reacciona explosivamente con agua o hielo a bajas temperaturas. Está clasificado como material peligroso debido a su alta reactividad.
El cesio se puede almacenar en hidrocarburos saturados como aceite mineral y ampollas de vidrio de borosilicato selladas al vacío. Debido a su alta reactividad, solo puede manipularse bajo atmósfera de gas inerte o argón.
La química del cesio es similar a la de otros metales alcalinos debido a la presencia de electrones 6s. La principal diferencia entre la primera y la segunda energía de ionización sugiere que el número de oxidación o estado preferido del metal Cs es +1. Es el elemento natural más electropositivo de la tabla periódica.
compuestos de cesio
La química principal del cesio está en forma de Cs+ ion. Se une a diferentes aniones para formar diferentes compuestos iónicos.
Las sales de fosfato, acetato, carbonato, haluros, óxido, nitrato y sulfato son solubles en agua, pero las sales dobles son menos solubles. El hecho se utiliza para refinar el metal Cs a partir de sus minerales. Forma sal doble poco soluble con antimonio, bismuto, cadmio, cobre, hierro y plomo.
Como otros cationes metálicos, el cesio actúa como un ácido de Lewis produciendo compuestos complejos con bases de Lewis. Asume un número de coordinación mayor que seis debido a sus grandes dimensiones Cs.+ catión.
Óxidos
Como otros metales alcalinos, el cesio produce una serie de óxidos binarios con átomos de oxígeno. Superóxido (CsO2) es el producto principal cuando se quema con oxígeno. También forma óxido de cesio (Cs2O) y peróxido (Cs2O2) cuando se mantiene el estado deseado.
También se han obtenido varios subóxidos de colores brillantes. Estos pueden incluir,
- cs7O: color bronceado, punto de fusión 4,3 °C.
- cs4O: color rojo violeta, se descompone a 10,5 °C.
- cs11O3: color violeta, punto de fusión 52,5 °C.
- Cs no estequiométricas3+xO (x a 1): se descompone a 166 °C.
hidróxido de cesio
Al igual que el hidróxido de sodio o el hidróxido de potasio, el hidróxido de cesio (CsOH) es una base fuerte. Es de naturaleza extremadamente higroscópica debido a la fuerte reactividad del metal alcalino Cs. En general, no puede ser utilizado en laboratorios debido a su alta reactividad y costo de producción.
haluros de cesio
El fluoruro de cesio (CsF) y el cloruro de cesio (CsCl) son los haluros de metal Cs más comunes. CsF es un sólido blanco y de naturaleza higroscópica. Es ampliamente utilizado como fuente de aniones de fluoruro en la química de organofluorados. CsCl es una red cristalina cúbica simple.
Proceso de producción
Se puede producir una escala más pequeña de cesio y otros metales alcalinos a partir de minerales contaminados. Se puede extraer principalmente de la contaminación a través del proceso de digestión ácida. La roca de silicato de polucita se puede disolver con un ácido fuerte como el ácido clorhídrico o el ácido sulfúrico.
La disolución del ácido clorhídrico crea una mezcla de cloruros solubles. Las sales dobles insolubles de Cs se pueden precipitar como Cs4SbCl7cs2CI y Cs2(CeCl6). Después de la separación, la sal doble precipitada pura se descompone en CsCl puro por evaporación con agua.
Al disolver el ácido sulfúrico, la polucita da sal doble insoluble o alumbre de cesio, CsAl(SO4)212H2O. El componente de sulfato de aluminio del alumbre se convierte en alúmina insoluble al tostarlo con carbón. El producto resultante se lixivia con agua para obtener un Cs. para producir2ASI QUE4 solución.
La mayor parte de la sal de cesio se puede convertir directamente en formiato de Cs para aplicaciones de perforación petrolera.
El metal también se puede aislar por electrólisis de cianuro de cesio fundido bajo una atmósfera inerte. Se puede producir Cs de alta pureza y libre de gas mediante la descomposición térmica de CsN de azida de cesio3 a 390°C.
El cesio puro es un metal alcalino muy caro, pero los compuestos son relativamente más baratos.
uso de cesio
- En la industria del petróleo, el formiato de cesio compuesto se utiliza como fluido de perforación. Se obtiene una solución acuosa de formiato de cesio por reacción de CsOH con ácido fórmico.
- Los relojes atómicos basados en cesio se utilizan para controlar el tiempo en Internet y en las redes de telefonía celular. También se utiliza en satélites GPS (Global Positioning System).
- Se utiliza en células fotoeléctricas debido a sus propiedades fotoemisivas.
- Se utiliza como patrón interno en el análisis de espectrofotometría.
- Al igual que otros metales alcalinos, también tiene una gran afinidad por el oxígeno. Por eso se utiliza en tubos de vacío.
- El dopaje con Cs aumenta la eficacia de los catalizadores de iones metálicos en la síntesis de ácido acrílico, antraquinona, óxido de etileno, metanol, anhídrido ftálico, estireno y varias olefinas.
- En la producción de ácido sulfúrico, Cs mejora la conversión catalítica de dióxido de azufre a trióxido de azufre.















Deja una respuesta