
Que principal diferencia entre IDH1 e IDH2 es que la isocitrato deshidrogenasa 1 (IDH1) es una enzima citosólica codificada por el gen IDH1 en humanos, mientras que la isocitrato deshidrogenasa 2 (IDH2) es una enzima mitocondrial codificada por el gen IDH2 en humanos.
El estrés oxidativo ocurre cuando un sistema biológico, como una célula, no puede desintoxicar fácilmente los intermedios reactivos (especies reactivas de oxígeno) o reparar el daño causado por los intermedios reactivos. Las alteraciones en el estado redox normal de la célula pueden producir efectos tóxicos a través de la producción de peróxidos y radicales libres. Los peróxidos y los radicales libres pueden dañar todos los componentes de una célula, incluidas las proteínas, los lípidos y el ADN. IDH1 e IDH2 son dos proteínas enzimáticas involucradas en la mitigación del daño oxidativo a la célula biológica.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es IDH1?
3. ¿Qué es IDH2?
4. Similitudes - IDH1 e IDH2
5. IDH1 frente a IDH2 en forma tabular
6. Resumen - IDH1 frente a IDH2
¿Qué es IDH1?
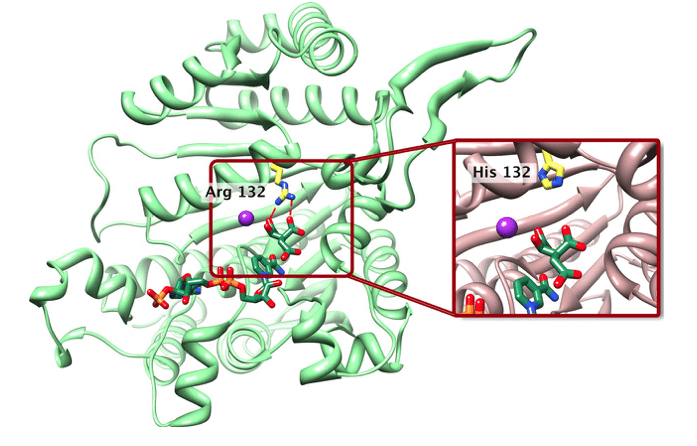
IDH1 es una enzima citosólica codificada por el IDH1 gen en humanos. Que IDH1 El gen está presente en el cromosoma 2. En una célula, la enzima IDH1 actúa en el citoplasma, peroxisoma y retículo endoplásmico. Esta enzima cataliza la descarboxilación oxidativa de isocitrato a α-cetoglutarato. Esta reacción permite la reducción de NADP+ a NADPH. Dado que el α-cetoglutarato y el NADPH desempeñan un papel en los procesos de desintoxicación celular debido al estrés oxidativo, IDH1 también participa indirectamente en la mitigación del daño oxidativo. Además de las funciones anteriores, IDH1 también cataliza la β-oxidación de ácidos grasos insaturados en los peroxisomas de las células hepáticas. Además, participa en la regulación de la secreción de insulina inducida por glucosa. Aparte de eso, IDH1 funciona como el principal productor de NADPH en la mayoría de los tejidos, incluido el cerebro.

Figura 01: IDH1
IDH1 Una mutación genética conduce a la producción anormal de 2-hidroxiglutarato, que inhibe las enzimas dependientes de alfa-cetoglutarato, como las histonas y las ADN desmetilasas. Esto puede conducir a cambios en la metilación de las histonas y del ADN, lo que desencadena la tumorigénesis. mutación en IDH1 Gene causa condromatosis metafisaria con aciduria. Esta mutación genética también se observa en astrocitoma difuso, astrocitoma anaplásico, oligodendroglioma, oligodendroglioma anaplásico, oligoastrocitoma, oligoastrocitoma anaplásico y glioblastoma secundario. Aparte de eso, la mutación IDH1 también se observa en la leucemia mieloide aguda humana. Algunos medicamentos, como el ivosidenib, que se usa para tratar la leucemia mieloide aguda IDH1 mutación, han sido aprobados por la FDA
¿Qué es IDH2?
IDH2 es una enzima mitocondrial. El gen IDH2 codifica esta enzima. El gen IDH2 está presente en el cromosoma 15 en humanos. Similar a la enzima IDH1, la enzima IDH2 también cataliza la descarboxilación oxidativa de isocitrato a α-cetoglutarato. IDH2 se encuentra principalmente en las mitocondrias y juega un papel importante en el metabolismo intermedio y energético. Esta proteína interactúa estrechamente con el complejo piruvato deshidrogenasa.

Figura 02: IDH2
Mutación somática de IDH2 También se ha descubierto que el gen está relacionado con afecciones como la enfermedad de Ollier y el síndrome de Maffucci. Además, una mutación en el gen IDH2 es responsable de varias otras enfermedades, como la aciduria 2-hidroxiglutárica, el glioma, la leucemia mieloide aguda, el condrosarcoma, el colangiocarcinoma intrahepático y el linfoma de células T angioinmunoblástico. Enasidenib es un fármaco aprobado por la FDA que se dirige a la leucemia mieloide aguda IDH2 Mutación.
¿Cuáles son las similitudes entre IDH1 e IDH2?
- IDH1 e IDH2 son dos enzimas involucradas en la mitigación del daño oxidativo a la célula biológica.
- Ambas son proteínas formadas por aminoácidos.
- Estas enzimas son dependientes de NADP+.
- Ambas enzimas catalizan la descarboxilación oxidativa de isocitrato a α-cetoglutarato.
- Las mutaciones en sus genes pueden causar diversos tumores como glioma, leucemia mieloide aguda, condrosarcoma, colangiocarcinoma intrahepático y linfoma angioinmunoblástico de células T.
- Las mutaciones en los genes responden bien a la quimioterapia y la radioterapia.
¿Cuál es la diferencia entre IDH1 e IDH2?
IDH1 es una enzima citosólica codificada por el IDH1 gen en humanos, mientras que IDH2 es una enzima mitocondrial codificada por IDH2 gen en humanos. Entonces, esta es la principal diferencia entre IDH1 e IDH2. junto al IDH1 El gen se encuentra en el cromosoma 2 mientras que el IDH2 El gen está en el cromosoma 15.
Resumen: IDH1 frente a IDH2
IDH1 e IDH2 son dos enzimas que catalizan la descarboxilación oxidativa de isocitrato a α-cetoglutarato. También catalizan la reducción de NADP+ a NADPH. Dado que el α-cetoglutarato y el NADPH actúan en los procesos de desintoxicación celular por estrés oxidativo, IDH1 e IDH2 también están implicados indirectamente en la mitigación del daño oxidativo. IDH1 es una enzima citosólica, mientras que IDH2 es una enzima mitocondrial. Entonces, este es el resumen de la diferencia entre IDH1 e IDH2.
Relación:
1. "IDH1" Una visión general | Temas de ScienceDirect.
2. "IDH2" Una visión general | Temas de ScienceDirect.
Imagen de cortesía:
1. "Estructuras IDH1 mutantes y de tipo salvaje" Por John H. Morris et al. Mol Cell Proteómica 2010; 9: 1703-1715 (CC BY 4.0) a través de Commons Wikimedia
2. "Proteína IDH2 PDB 1lwd" por Emw - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia

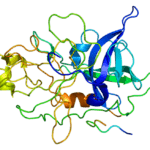








Deja una respuesta